不同类型抗体储存时注意要避免污染或损失请每次均查看抗体说明书是否有特殊的保存要求。Abcam 公司对于非正确保存的抗体不保证其有效。对于保存适当的抗体,大多数的活性保持时间为数个月甚至数年。

8% 多聚甲醛溶液配制时应60°C 加热搅拌(温度不要超过60°C)。溶液达到60°C 时多聚甲醛溶解,加入500ml 0.2mM 磷酸盐缓冲液,使0.1mM 磷酸盐缓冲液中含4% 多聚甲醛。小心滴加1 当量的氢氧化钠溶液直至溶液澄清(每500ml 滴加1 至2 滴;如果仍未澄清,可继续滴加。或者,可在1 至2L 溶液中加入2 粒固体氢氧化钠)。溶液变冷后过滤。

三乙醇胺-吐温缓冲液(含0.1% 的吐温20)
配制1L 溶液:取100ml 10 倍三乙醇胺缓冲液加890ml 超纯水,再加入10ml 吐温20 (10%)吐温20 很粘稠会粘在量取的枪头上,要确定加入三乙醇胺缓冲液的变性剂体积足够。建议使用10% 的溶液进行配制,会比用未稀释的吐温20 溶液容易配制。


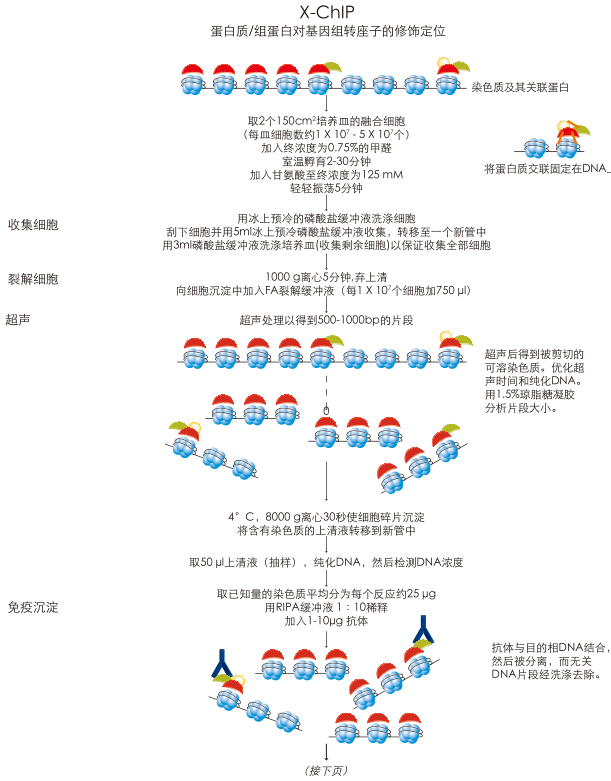
染色质免疫共沉淀是一种强力的手段,来联系蛋白质或其修饰位点与基因组的关系。染色质分离并用特异性抗体判断是否与特异性DNA 序列相结合。染色质免疫沉淀法亦可用来检测目的位点在基因组中的时空分布(用芯片或DNA 测序)。本操作规程详细阐述了交联染色质免疫沉淀(X-ChIP) 实验的具体步骤。

此方法涉及抗IgM 抗体的IgG 耦联蛋白A 或G 珠子(方法见下文)。这些珠子就可以在常规免疫共沉淀程序中使用IgM 抗体。通过结合抗-IgM 抗体,IgM 可以间接结合珠子。

为了使洗脱蛋白较少污染抗体,也为了更纯净蛋白质的制备和干净的免疫印迹实验,推荐将抗体与珠子交联。下面是一个实验程序举例(几个网站有关于这个程序有很多信息)。目标蛋白应该用温和的洗脱液洗脱,如甘氨酸缓冲液。

为了使洗脱蛋白较少污染抗体,也为了更纯净蛋白质的制备和干净的免疫印迹实验,推荐将抗体与珠子交联。下面是一个实验程序举例(几个网站有关于这个程序有很多信息)。目标蛋白应该用温和的洗脱液洗脱,如甘氨酸缓冲液。更详细的缓冲液配方可在缓冲液章节找到,第71页。

裂解物预清除可以帮助减少蛋白质非特异性结合到agarose (琼脂糖)或Sepharose beads (凝胶琼脂糖珠)。用无关抗体或血清预清除,可去除蛋白质与免疫球蛋白的非特异结合。最终实验结果背景降低并且信噪比提高。但是,如果最后蛋白质是由免疫印迹实验检测,预清除未必必要,除非是污染蛋白质对目的蛋白质产生明显干扰。

免疫沉淀是一种纯化蛋白质的方法。将我们感兴趣的一种蛋白质的抗体与细胞提取液孵育,以使抗体和蛋白质在溶液中结合。然后用蛋白A/G 耦合的琼脂糖凝胶,从样品中将抗体/抗原复合物提取出来。这种物理方法可将所需蛋白质从样品中分离出来。然后样品可以通过SDS-PAGE 分离出来进行Western blot 分析。


微信扫码在线客服