T细胞耗竭(T Cell Exhaustion)是指在长期感染或患有癌症等疾病的情况下,T细胞功能发生不可逆的衰退现象。这种现象主要是由于持续性暴露于抗原或长期存在的炎症导致的,使得T细胞逐渐失去了其正常的效应功能和记忆T细胞的特征。T细胞耗竭在肿瘤免疫、感染免疫和自身免疫等方面扮演着重要的角色。
对T细胞耗竭的研究一直以来都备受关注,尤其在疫苗开发、靶向治疗药物干预等领域中被视为攻坚重点。许多顶级期刊、基金资助项目、临床研究和药物开发上市等方面都集中关注这一领域。
为了更好地理解和应对T细胞耗竭,我们可以从相关的文章中获取一些思路和启示。这些文章涉及多个方面,帮助我们深入了解T细胞耗竭的机制、治疗策略和药物研发等方面的最新进展。通过这些研究,我们可以为未来的免疫治疗和疫苗研发提供有力支持,从而为患者带来更好的治疗效果。
1、Microenvironmental ammonia enhances T cell exhaustion in colorectal cancer
Cell Metab(IF:29.0) DOI:https://doi.org/10.1016/j.cmet.2022.11.013
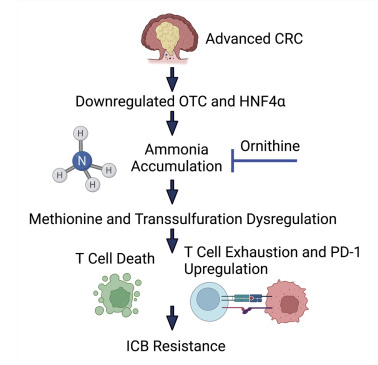
对于晚期结直肠癌(CRC)患者缺乏有效的治疗方法。CRC肿瘤微环境由于代谢改变和接近微生物群而具有升高的代谢废物。代谢废物在肿瘤发生、进展和治疗耐药性中的作用尚不清楚。研究人员建立了一个CRC的原位转移小鼠模型,并使用无偏的多组学分析来揭示肿瘤氨的稳健积累。高氨水平诱导T细胞代谢重编程,增加耗竭,并减少增殖。CRC患者血清氨水平升高,氨相关基因特征与T细胞反应改变、患者不良结局以及对免疫检查点阻断缺乏反应相关。证明提高氨清除率重新激活T细胞,减少肿瘤生长,并延长生存期。此外,减少肿瘤相关的氨增强抗PD-L1功效。这些发现表明,增强氨解毒可以重新激活T细胞,突出了增强免疫疗法疗效的新方法。
2、SULT2B1-CS-DOCK2 axis regulates effector T-cell exhaustion in HCC microenvironment
Hepatology(IF:14.0);DOI: 10.1097/HEP.0000000000000025
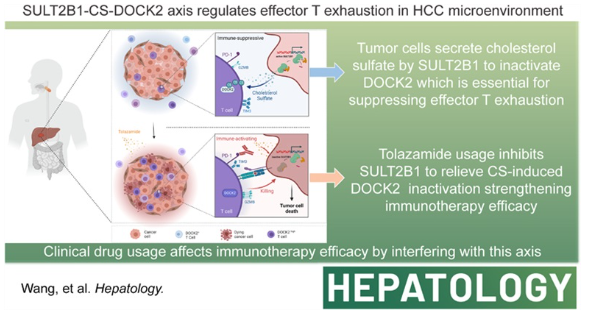
背景和目标:
HCC是一种恶性疾病。 与酪氨酸激酶抑制剂(经典疗法)相比,免疫检查点抑制剂在治疗HCC方面更有效,尽管其疗效有限。 在这些限制因素中,肿瘤浸润的淋巴细胞,特别是CD8+ T细胞的耗竭是核心事件。 我们的目的是确定导致HCC中CD8+ T细胞浸润的关键因素,并研究其潜在机制。
方法和结果:
使用机器学习和多重免疫组织化学分析,我们表明胞质分裂蛋白2(DOCK 2)的奉献者是HCC中浸润的CD8+ T细胞的潜在指标。 使用RNA测序、流式细胞术分析和小鼠肝癌模型,我们证明DOCK 2失活是肿瘤中浸润的CD 8 + T细胞耗尽的原因。 利用准靶向代谢组学、质谱和质谱飞行时间分析,我们发现肿瘤细胞中磺基转移酶2B1合成的胆固醇硫酸酯抑制了T细胞的DOCK 2酶活性。 通过虚拟筛选、分子对接模拟和实验验证,我们证明妥拉磺酰胺逆转DOCK 2失活介导的CD8+ T细胞耗竭,增强抗程序性死亡配体1抗体+阿帕替尼对肝癌的免疫抑制作用。
3、Sex-Biased T-cell Exhaustion Drives Differential Immune Responses in Glioblastoma
Cancer Discov(IF:29.1);https://doi.org/10.1158/2159-8290.CD-22-0869
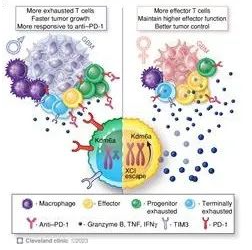
胶质母细胞瘤(GBM)发病率和结局的性别差异已得到充分认识,新的证据表明,这些差异可扩展至遗传/表观遗传和细胞差异,包括免疫应答。 然而,驱动免疫性别差异的机制尚未完全理解. 在这里,我们证明T细胞在驱动GBM性别差异中起着关键作用。 雄性小鼠表现出加速的肿瘤生长,肿瘤中CD 8 + T细胞的频率降低和耗竭增加。 此外,在雄性中发现祖细胞耗竭T细胞的频率更高,对抗PD-1治疗的反应性改善。 此外,在男性GBM患者中观察到T细胞耗竭增加。 骨髓嵌合体和过继转移模型表明,T细胞介导的肿瘤控制主要以细胞内源性方式调节,部分由X染色体失活逃逸基因Kdm 6a介导。 这些发现表明,T细胞的性别偏向性预定行为对于诱导GBM进展和免疫治疗应答的性别差异至关重要。
重要性:
由于多种因素,包括GBM中高度免疫抑制性肿瘤微环境,GBM患者的免疫治疗一直不成功。 本研究表明性别偏向性T细胞行为主要是内在调节的,进一步表明性别特异性方法可用于潜在地提高GBM免疫治疗的疗效。
4、FPR2 Shapes an Immune-Excluded Pancreatic Tumor Microenvironment and Drives T-cell Exhaustion in a Sex-Dependent Manner
Cancer Res(IF:11.2);https://doi.org/10.1158/0008-5472.CAN-22-2932
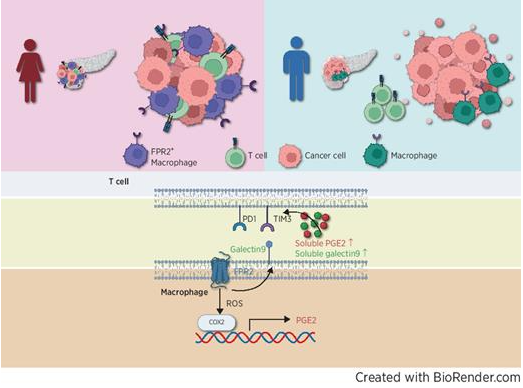
性别驱动的免疫差异可以影响肿瘤进展和肿瘤微环境的景观。 深入了解男性和女性的这些差异可以为患者选择提供信息,以改善性别优化的免疫治疗。 在这项研究中,单细胞RNA测序和蛋白质分析揭示了胰腺病变中的髓样细胞亚群与免疫排斥肿瘤表型和效应T细胞耗竭仅在女性中相关。 这种骨髓亚群与女性中M2样巨噬细胞的存活率和遗传特征以及T细胞耗竭呈正相关。 G蛋白偶联受体甲酰肽受体2(FPR 2)介导这些免疫抑制作用。 在体外,用特异性FPR 2拮抗剂处理骨髓细胞可防止效应细胞的耗竭并增强其细胞毒性。 蛋白质组学分析显示,FPR 2激动剂处理后,雌性M2样巨噬细胞中免疫抑制分泌蛋白PGE 2和半乳糖凝集素-9的高表达,整合素途径丰富,促炎信号如TNFα和IFNγ减少。 此外,用FPR 2激动剂处理的骨髓细胞仅在雌性T细胞中诱导TIM 3和PD-1表达。 用抗TIM 3抗体治疗逆转并刺激其浸润和杀死胰腺球状体的能力。 在体内,与野生型(WT)雌性小鼠以及WT和FPR 2 KO雄性小鼠相比,FPR 2敲除(KO)雌性小鼠中同基因胰腺肿瘤的进展受到显著抑制。 在雌性小鼠中,与WT巨噬细胞相比,用FPR 2 KO巨噬细胞接种肿瘤显著降低了肿瘤生长。 总的来说,这项研究确定了FPR 2在女性中的免疫抑制功能,突出了潜在的性别特异性精确免疫治疗策略。
意义:
FPR 2是胰腺癌中巨噬细胞功能的性别依赖性介质,可以靶向重编程巨噬细胞并刺激女性的抗肿瘤免疫。
5、Glycogen synthase kinase 3 controls T-cell exhaustion by regulating NFAT activation
Cell Mol Immunol(IF:24.1); https://www.nature.com/articles/s41423-023-01075-0
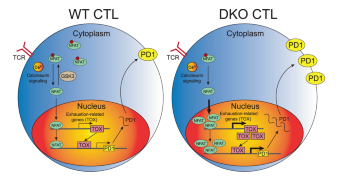
由CD 8 + T细胞介导的细胞免疫在细菌和病毒清除和癌症中起着不可或缺的作用。 然而,CD 8 + T细胞的持续抗原刺激导致衰竭或功能失调的细胞状态,其特征在于在慢性病毒感染期间和肿瘤中效应子功能的丧失和抑制性受体的高表达。 大量研究表明,糖原合成酶激酶3(GSK 3)控制免疫细胞的功能和发育,但GSK 3是否影响CD 8 + T细胞尚未明确阐明。 在这里证明了在活化的CD 8 + T细胞(DKO)中Gsk 3 α和Gsk 3 β缺失的小鼠在急性和慢性病毒感染期间表现出CTL分化和效应功能降低。 此外,DKO小鼠未能控制肿瘤生长,这是由于肿瘤浸润性CD 8 + T细胞中抑制性受体的表达上调和T细胞耗竭增加。 引人注目的是,抗PD-1免疫疗法基本上恢复了DKO小鼠的肿瘤排斥反应。 从机制上讲,GSK 3通过抑制TCR诱导的NFAT核输入来调节T细胞耗竭,从而反过来抑制NFAT介导的耗竭相关基因表达,包括TOX/TOX 2和PD-1。 因此,揭示了抗肿瘤免疫应答中GSK 3调节CTL分化和T细胞耗竭的分子机制。

微信扫码在线客服