2012年,俞立教授在NRK细胞(大鼠肾上皮细胞)的电镜图片中无意间发现了一些不寻常的结构,它们是一个在细胞外类似于 “开口石榴”的囊泡结构,有膜包被,内部有很多小囊泡,大小在0.5-3 μm。这个新型结构的发现,引起了俞立教授团队的研究热情。关于这一新细胞器的研究就此拉开了序幕。
细胞在迁移时会留下收缩丝,而在收缩丝的顶端或分叉处,能形成迁移体。迁移体是一种大囊泡样结构且内带有小囊泡的细胞器,在通过收缩丝与母体细胞保持联通时,能够作为母体细胞的一部分执行多种功能,在收缩丝断裂时,也能够作为完全独立于母体细胞的个体,以细胞外囊泡的方式发挥功能。目前,课题组已报道的,迁移体参与的多种生理过程有:细胞间mRNA转运【2】,线粒体质量控制【3】,器官发育【4】,血管新生【5】等。
2023年7月24日,清华大学生命科学学院、膜生物学国家重点实验室俞立课题组在Nature Cell Biology在线发表了题为The formation of migrasomes is initiated by the assembly of sphingomyelin synthase 2 foci at the leading edge of migrating cells的研究论文,指明鞘磷脂合成酶2 (SMS2) 在迁移细胞前沿组装形成斑点,从而决定迁移体的生长位点。

迁移体的命运周期是一个生物信号响应与物理形变结合的精细调控过程,目前其形成机制研究比较表浅,课题组曾报道迁移体形成的理论框架: 四次跨膜蛋白TSPAN4能够自组装或者整合其他跨膜蛋白及胞质蛋白,形成一种称为四次跨膜蛋白富集的微结构域,简称TEMs。在迁移体生成过程中TSPAN4组装的TEMs能够聚集形成?m级别的宏结构域(TEMAs),最终这些宏结构域使膜管形变,产生迁移体【6】。本文工作中,研究人员旨在系统性地获取可能调控迁移体命运周期的相关基因与信号调控网络,深入理解其生成机制。
研究人员首先利用蛋白质组学数据与生信分析建立筛选文库,结合病毒介导的RNAi技术与高内涵成像,筛选迁移体生成相关基因。接着利用脂质组学比较迁移体与细胞膜的脂质差异,两部分的数据一致性地为课题细化了切入点:鞘脂代谢。下一步,研究人员确认了鞘脂家族脂质的分布:神经酰胺 (ceramide) 富集于迁移体生成位点,鞘磷脂 (SM) 富集于迁移体和迁移体生成位点,验证了迁移体的生成需要神经酰胺 (ceramide),鞘磷脂 (SM) 并明确了其中参与调控的关键酶:神经酰胺合成酶Cers5, 鞘磷脂合成酶 SMS2与神经酰胺转运酶CERT。
鞘磷脂合成酶 SMS2能够通过介导鞘磷脂 (SM) 合成,调控迁移体生成与结构稳定,故研究人员对鞘磷脂合成酶 SMS2展开了进一步的研究,发现:SMS2蛋白在细胞前沿的,与胞外基质接触侧的细胞膜上能组装形成SMS2斑点,这些斑点决定迁移体的发生位点。迁移体的生成也需要SMS2蛋白组装形成SMS2斑点。
综上所述,研究人员认为迁移体生成过程包含以下过程:1)组装于细胞前沿的SMS2斑点决定迁移体生成位点;2)细胞迁移离开,锚定的SMS2斑点保留在收缩丝上成为迁移体生成位点;3)在SMS2斑点位置,神经酰胺转化成鞘磷脂,诱发迁移体进入生长阶段;4)TEMAs募集,进一步促进迁移体的生长与结构稳定。
本文工作首次报道了迁移体的命运发生起始于细胞前沿的位点决定,破除原有的迁移体生长于细胞后沿收缩丝的形态学认知,拓宽了迁移体命运发生的时空尺度,为未来上游胞内信号调控迁移体形成提供了可能的着眼点。其次,本文工作报道了鞘脂与鞘脂相关酶参与调控迁移体发生与结构稳定,丰富了迁移体生成的理论模型,也为未来研究利用迁移体作为模式结构探索膜结构域组装与功能提供新视角。此外,鞘脂与鞘脂相关酶在多种生理功能发挥中具有重要作用,为迁移体可能的生理功能与功能调节机制提供了新思路。
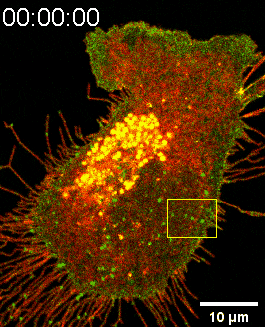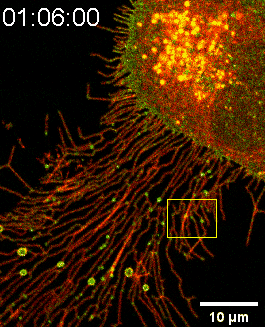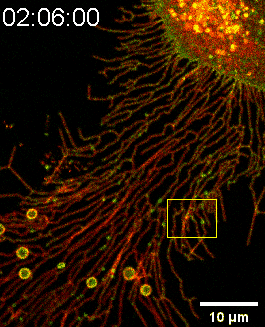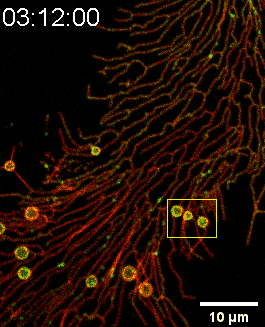
图一:SMS2-GFP亮点锚定在细胞底部后可生长成迁移体(Confocal Imaging)
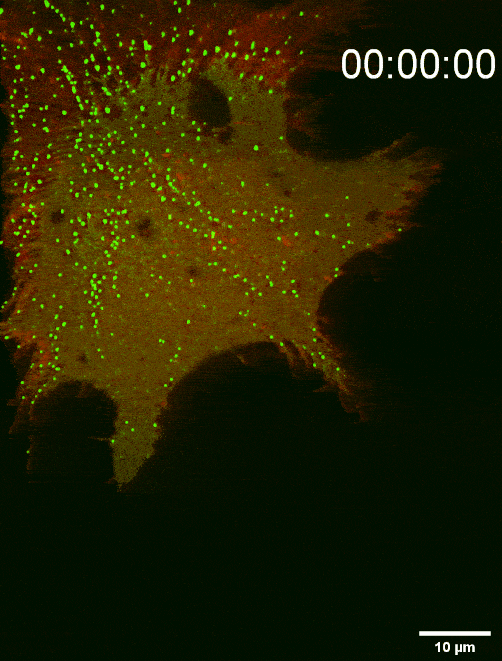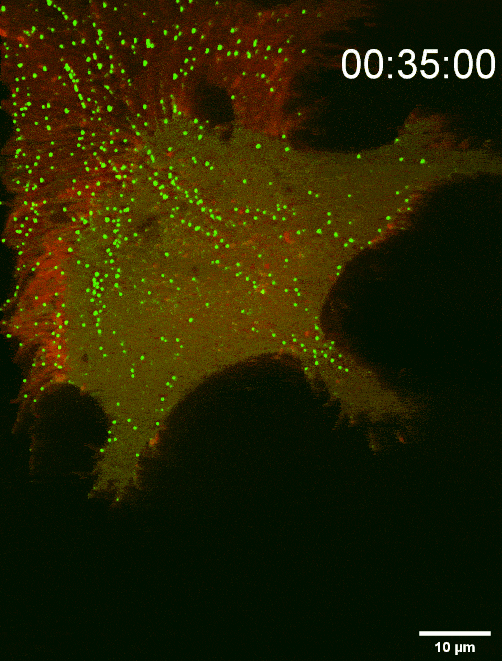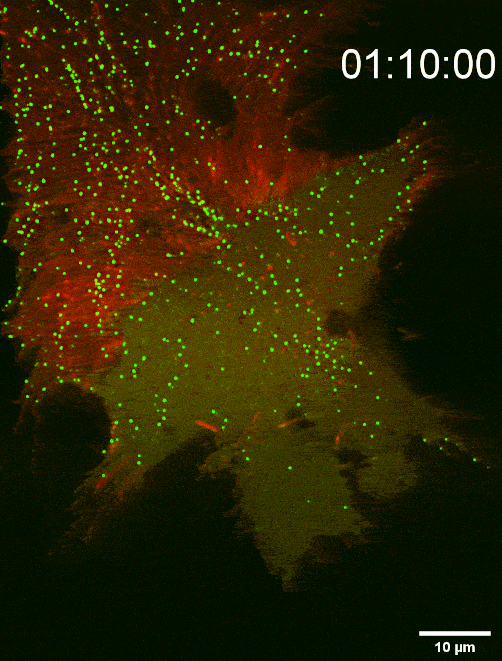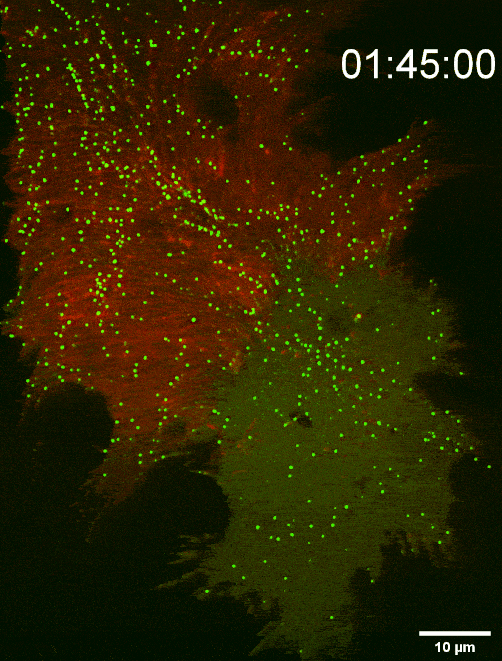
图二:组装于细胞前沿底部膜上的SMS2斑点决定迁移体生成位点(TIRF Imaging)
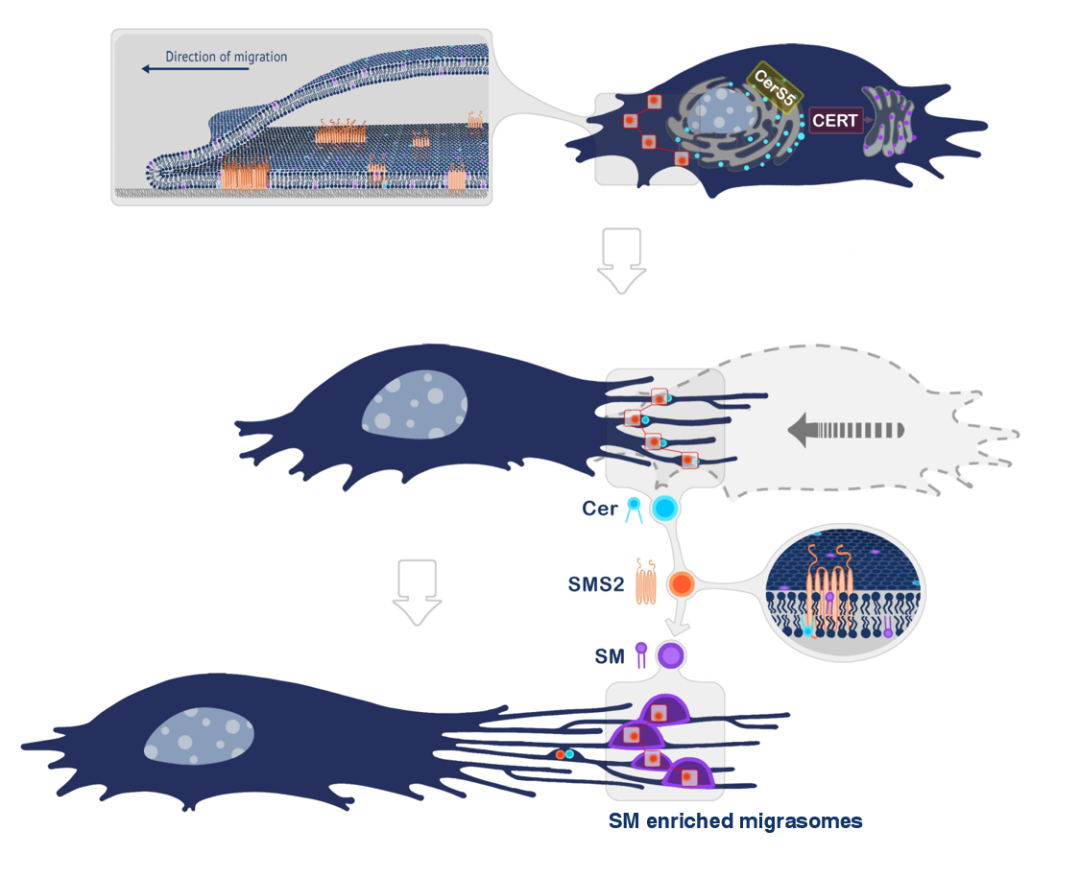
图三:SMS2调控迁移体生成的模式图
原文链接:
https://www.nature.com/articles/s41556-023-01188-8
参考文献:
1. Ma, L. et al. Discovery of the migrasome, an organelle mediating release of cytoplasmic contents during cell migration. Cell Res 25, 24-38 (2015).
2. Zhu, M. et al. Lateral transfer of mRNA and protein by migrasomes modifies the recipient cells. Cell Res 31, 237-240 (2021).
3. Jiao, H. et al. Mitocytosis, a migrasome-mediated mitochondrial quality-control process. Cell 184, 2896-2910 e2813 (2021).
4. Jiang, D. et al. Migrasomes provide regional cues for organ morphogenesis during zebrafish gastrulation. Nat Cell Biol 21, 966-977 (2019).
5. Zhang, C. et al. Monocytes deposit migrasomes to promote embryonic angiogenesis. Nat Cell Biol 24, 1726-1738 (2022).
6. Huang, Y. et al. Migrasome formation is mediated by assembly of micron-scale tetraspanin macrodomains. Nat Cell Biol 21, 991-1002 (2019).

微信扫码在线客服