骨骼肌肉系统具有重要的内分泌和免疫功能。运动的肌肉能分泌出多样细胞因子。包含了神经激素,脑源性神经营养因子(BDNF),抗炎症性细胞因子,炎症促进性细胞因子等提供内分泌和免疫物质。肌肉也是人体重要内分泌免疫系统。
2023年7月19日,浙江大学基础医学院孟卓贤研究员团队和浙江大学医学院附属儿童医院傅君芬教授团队合作在《Nature Communications》杂志在线发表题为“The muscle-enriched myokine Musclin impairs beige fat thermogenesis and systemic energy homeostasis via Tfr1/PKA signaling in male mice” 的研究论文,发现并揭示了骨骼肌分泌因子Musclin抑制脂肪细胞产热代谢,调控全身能量平衡的新机制。

该研究首先通过整合分析人骨骼肌样本的基因表达谱和分泌因子编码基因的组织分布图谱,筛选得到一个在肥胖患者的骨骼肌中显著上调,且在骨骼肌中特异性高表达的分泌因子Musclin。进一步利用大样本人群以及肥胖和T2D小鼠模型的骨骼肌和血液样本,作者发现Musclin在肥胖和T2D患者和小鼠骨骼肌中显著高表达,引起血浆中的蛋白水平显著上调,提示Musclin可能是促进肥胖及其相关代谢性疾病发生的一个重要风险因子(图1)。
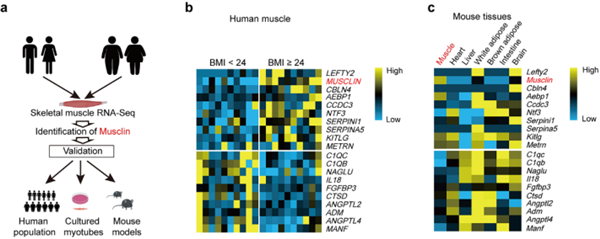
图1 骨骼肌分泌因子Musclin在超重或肥胖患者的骨骼肌中显著高表达
为了进一步研究Musclin对脂肪组织和全身代谢的影响,研究人员构建了两种Musclin gain-of-function小鼠模型:骨骼肌特异性Musclin转基因(MCK-Musclin)和AAV介导的Musclin过表达小鼠。研究发现,在正常饮食喂养条件下,Musclin过表达即可抑制小鼠的产热功能,增加皮下脂肪含量,而对小鼠的摄食和运动能力无明显影响。通过对经过慢性冷刺激处理的MCK-Musclin小鼠腹股沟皮下脂肪(iWAT)、棕色脂肪(BAT)、附睾脂肪(eWAT)及骨骼肌等多个组织器官进行基因表达谱分析,研究人员发现Musclin显著抑制iWAT中大量脂肪酸代谢、细胞呼吸、葡萄糖代谢以及适应性产热等通路相关基因的表达。这些结果提示,Musclin主要靶向皮下脂肪组织并抑制其产热功能。进一步研究发现MCK-Musclin或 AAV介导的Musclin过表达显著加重小鼠高脂饮食(HFD)诱导的肥胖及其相关代谢异常。
机制研究方面,研究人员借助体外细胞模型(C3H10T1/2分化的米色脂肪细胞),确定了Musclin蛋白对于米色脂肪细胞氧气消耗率(OCR)及糖脂代谢和产热基因表达的直接抑制效果,并且发现Musclin的抑制产热功能依赖于cAMP/PKA信号途径。接着,研究人员通过临近蛋白生物素标记技术(BioID)结合质谱技术分析Musclin-BirA*融合蛋白(BirA*是一种生物素连接酶)处理组与对照组细胞膜上被Biotin标记的差异蛋白,发现了Musclin在产热脂肪细胞上的新受体:Tfr1(转铁蛋白受体1)(图2)。进而,利用Tfr1脂肪细胞特异性基因敲降小鼠模型、SPR分子互作实验、以及基因敲降细胞模型等多种体内外研究手段,作者确定了Tfr1在米色脂肪细胞中选择性高表达,介导了Musclin对其产热代谢功能的选择性调控作用(图2)。
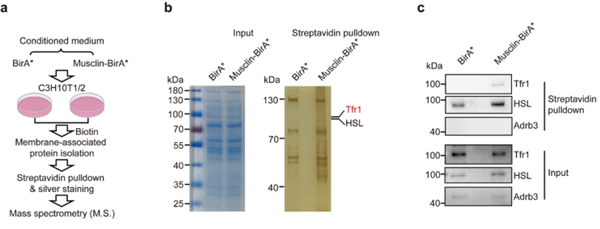
图2 Musclin在米色脂肪细胞上作用受体的筛选及验证
为了探索靶向抑制Musclin对肥胖及其相关代谢性疾病的治疗作用和潜在临床转化价值,研究人员构建了两种Musclin loss-of-function小鼠模型:骨骼肌特异性Musclin基因敲除(Musclin-MKO)小鼠和Musclin中和抗体处理(Musclin Ab)小鼠模型。研究结果显示:Musclin基因缺失或功能阻断均能显著增强小鼠皮下脂肪的产热功能、提高全身代谢率,进而改善高脂饮食(HFD)诱导的肥胖和代谢紊乱。这些结果进一步从反面验证了Musclin的产热代谢抑制效应,并提示Musclin可作为肥胖和T2D的潜在治疗新靶点。
综上所述,该研究从人群样本出发,筛选并发现骨骼肌分泌因子Musclin在肥胖患者骨骼肌和血液循环中显著高表达。进而,从正反两方面证明了其通过抑制米色脂肪细胞产热代谢、降低机体能量消耗,在全身糖脂代谢稳态调控中发挥重要作用。此外,该工作首次发现并确定了Musclin在产热脂肪细胞膜上的作用受体Tfr1,及其下游cAMP/PKA依赖的信号转导途径(图3)。
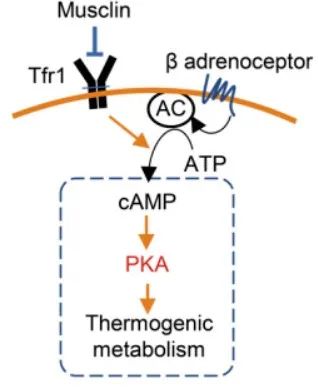
图3 Musclin靶向Tfr1/cAMP/PKA信号抑制脂肪细胞产热代谢
值得一提的是,过去研究发现了多个分泌因子能够促进棕色和米色脂肪的产热功能,而该研究首次报道了对皮下脂肪的产热代谢有显著抑制作用的肌肉分泌因子,通过骨骼肌-脂肪组织之间交叉对话调控脂肪产热功能和全身代谢稳态,为肥胖及其相关代谢性疾病的诊治提供了潜在新型生物标志物和干预新靶点(相关发明专利已申请)。
浙江大学基础医学院孟卓贤研究员为论文的最后通讯作者,浙江大学附属儿童医院傅君芬教授为共同通讯作者。浙江大学医学院金露博士(已毕业)、韩爽博士后(已出站)、在读博士生吕雪、连云港市第一人民医院运动医学科李小飞副主任医师为论文共同第一作者。该课题得到基础医学院Dante Neculai教授、陈伟教授和武鹏博士的大力支持。研究获得国家自然科学基金、科技部国家重点研发计划、浙江省自然科学基金、浙江大学基础医学院原创探索培育计划项目等基金项目的资助。
论文链接:
https://doi.org/10.1038/s41467-023-39710-z

微信扫码在线客服