选择合适的微珠,汇总表
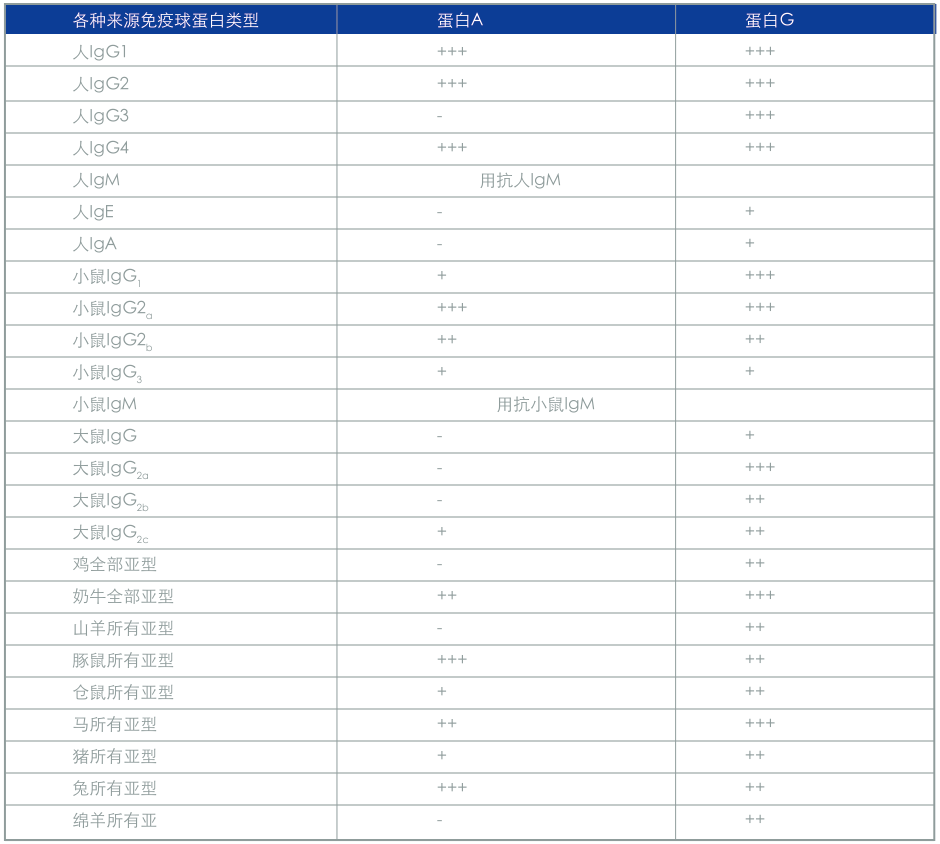
Key: +++ = Strong binding, ++ = Medium binding, + = Weak binding, - = No binding
参考资料
Harlow, Ed, and David Lane. Using Antibodies. Cold Spring Harbor, New York: Cold Spring Harbor Laboratory Press, 1999.Bonifacino, Juan S. et al. Current Protocols in Immunology 8.3.1-8.3.28, New York: John Wiley, 2001.
使抗体与微珠交联的步骤:
降低洗脱蛋白质溶液中污染的抗体数量:
为了使洗脱蛋白较少污染抗体,也为了更纯净蛋白质的制备和干净的免疫印迹实验,推荐将抗体与珠子交联。下面是一个实验程序举例(几个网站有关于这个程序有很多信息)。目标蛋白应该用温和的洗脱液洗脱,如甘氨酸缓冲液。更详细的缓冲液配方可在缓冲液章节找到,第71页。
试剂:
交联试剂:
邻苯二甲酸二甲酯(DMP)
储液浓度13mg/ml
洗脱试剂:
1M 甘氨酸(加浓盐酸调整pH 值至3)
稀释缓冲液:
PBS+ 1mg BSA 每1ml PBS
洗涤缓冲液:
含0.2M 三乙醇胺的PBS(每100ml 缓冲液中含3.04ml 三乙醇胺)
淬灭缓冲液:
含50mM 乙醇胺的PBS(311.7μl/100ml)
准备工作:
1.珠子用PBS 洗2 次。最终浓度为50% 珠浆。
2. PBS 混合均匀并4°C 旋转过夜。
交联:
1.微量离心机(14000rpm 1分钟)离心沉淀以洗涤珠颗粒。吸出PBS 上清液。
2. 1:1 比例加入稀释缓冲液,轻轻混合并4°C 旋转10 分钟。微型离心机离心并如上吸出/摒弃上清。
3. 按需要的浓度用抗体稀释缓冲液准备抗体溶液(参见抗体说明书的建议浓度)。1:1 比例将抗体加入,轻轻混合并4°C 旋转1 小时。
4. 离心并吸出/摒弃上清。
5. 1:1 的比例将稀释缓冲液加入,4°C 旋转5 分钟。离心并吸出/摒弃上清液。
6. 1:1 的比例将PBS 加入,离心并吸出/摒弃上清液。
7.交联:
用1ml 洗涤缓冲液,溶解1ml 准备好的13mg/ml DMP 储液。迅速漩涡震荡混合。1:1 的比例将DMP 溶液加入,室温(RT)旋转30 分钟。
(DMP 在水溶液中不稳定。使用前快速配制。)
注意:您需要确认DMP 在加入珠子前后的pH 值均在8-9 之间(在此pH 值范围以外,交联效率将大大降低)。
用洗涤缓冲液洗涤珠子(室温旋转5 分钟,离心并吸出/摒弃上清液)。
1:1 比例第二次加入DMP,室温旋转30 分钟,按之前方法洗涤。
1:1 比例第三次加入DMP,室温旋转30 分钟,按之前方法洗涤。
7. 淬灭和洗涤。
1:1比例加入淬灭缓冲液,室温旋转5 分钟,离心并吸出/摒弃上清液;重复该步骤。用PBS 洗。
8. 去除多余的(未交联)抗体:
用1M 甘氨酸(pH3)洗涤。室温旋转10 分钟,离心并吸出/摒弃上清液;重复该步骤。
9. 存储洗涤。
用免疫沉淀缓冲液洗涤(通常是PBS+吐温)。室温旋转5 分钟。洗三次,最后一次旋转后保存。珠子可以在4°C 储存几天。可以加入0.02 - 0.05% 叠氮钠W/V 防止细菌生长。
免疫沉淀:
结合抗体的珠子现在可以进行如上常规IP 实验流程。为了防止抗体与目标蛋白质一起洗脱,用温和的甘氨酸梯度洗脱(可到1M)。
下一篇:免疫沉淀—如何用IgM 抗体进行

微信扫码在线客服