新型隐球菌又名溶组织酵母菌,是土壤,鸽类,牛乳、水果等的腐生菌,也可存在人口腔中,可侵犯人和动物,一般为外源性感染,但也可能为内源性感染,对人类而言,它通常是条件致病菌。本菌大多由呼吸道转入,在肺部引起轻度炎症,或隐性传染。亦可由破损皮肤及肠道传入。当机体免疫功能下降时可向全身播散,主要侵犯中枢神经系统,发生真菌性脑膜炎、脑炎、脑肉芽肿等,此外可侵入骨骼、肌肉、淋巴结、皮肤粘膜引起慢性炎症和脓肿。
在新型隐球菌感染过程中,嗜酸粒细胞(eosinophil)在感染的肺部会增加并且早期研究发现,缺乏嗜酸粒细胞的小鼠对新型隐球菌的感染和引发的疾病具有抗性【3】,这表明嗜酸粒细胞在新型隐球菌感染过程中起着重要作用,但嗜酸粒细胞是如何被招募到感染部位缺一直不清楚。
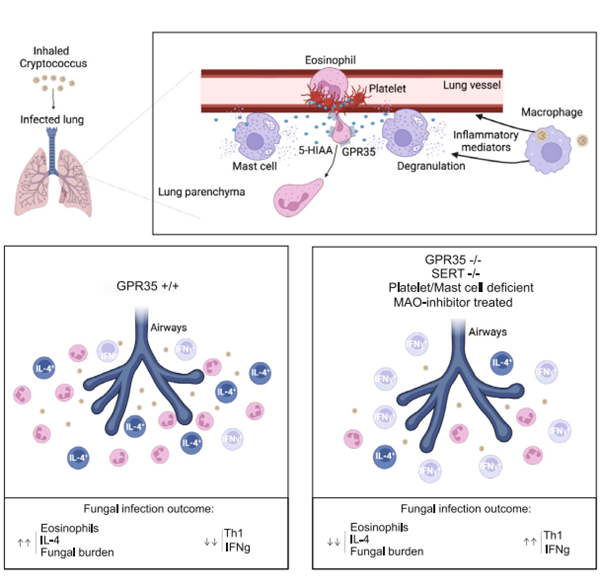
2023年6月5日,来自美国加州大学微生物与免疫学系、霍华德·休斯医学研究所(HHMI)的教授Jason G. Cyster(Marco De Giovanni为第一作者)在Immunity杂志上发表了题为 Platelets and mast cells promote pathogenic eosinophil recruitment during invasive fungal infection via the 5-HIAA-GPR35 ligand-receptor system 的研究论文,揭示了新型隐球菌感染时血小板和肥大细胞通过分泌5-羟基吲哚乙酸(5-HIAA)并结合其受体GPR35来招募嗜酸粒细胞,进而引发疾病的机制。

在这项研究中,研究人员发现与Gpr35+/-小鼠相比,Gpr35-/-小鼠在感染新型隐球菌KN99菌株后,其肺部和脾脏内的菌落总数(CFU)以及肺部的嗜酸粒细胞数明显减少。通过使用Gpr35-/-或WT小鼠骨髓在辐射小鼠中重建骨髓进行实验,研究人员同样观察到对新型隐球菌KN99菌株感染数和肺部嗜酸粒细胞数的下降。此外,通过分析感染新型隐球菌的1:1混合的Gpr35-/-和WT骨髓重建小鼠,研究人员发现招募到感染肺部的Gpr35-/-嗜酸粒细胞数量明显少于WT嗜酸粒细胞数量。在骨髓重建小鼠中过表达Gpr35,能够减轻新型隐球菌感染并减少肺部嗜酸粒细胞的总数。此外,与对照组相比,嗜酸粒细胞内特异性缺乏Gpr35的骨髓重建小鼠,其肺部菌落总数(CFU)以及肺部的嗜酸粒细胞数也明显减少。这些结果表明嗜酸粒细胞内Gpr35的表达促进了新型隐球菌的感染和嗜酸粒细胞的招募。
以往的研究表明,在新型隐球菌感染中,CD4辅助T细胞发挥关键作用,特别是与清除肺部新型隐球菌相关的IL4表达的T辅助细胞【4,5】。通过对比分析感染KN99菌株后的CD4 T细胞亚型,研究人员发现与Gpr35+/-小鼠相比,Gpr35-/-小鼠肺部内分泌IL4的Th2细胞减少,而分泌IFNγ的Th1细胞增加。这些结果表明Gpr35介导的嗜酸粒细胞招募在促进肺部的Th2效应反应中起着重要作用。
2022年作者发表在Cell上另一项研究表明,5-羟基吲哚乙酸(5-HIAA)是Gpr35的配体(详见BioArt报道:Cell | GPR35促进中性粒细胞募集)【6】,并且在感染时主要由血小板和肥大细胞分泌。研究人员通过使用单胺氧化酶(MAO)抑制剂phenelzine抑制5-HIAA的生成,并通过基因缺失特异性减少血小板和肥大细胞内5-HIAA的生成进行实验,发现在新型隐球菌感染时其与Gpr35缺失具有一样的表型,即KN99菌株感染数和肺部嗜酸粒细胞数的下降。
总的来说,该研究结果表明:1)GPR35在嗜酸粒细胞中作为趋化受体发挥作用;2)血小板和肥大细胞释放的5-HIAA有助于招募嗜酸粒细胞进入感染的肺部;3)GPR35嗜酸粒细胞的招募改变了Th细胞的活性并减少了真菌的清除;4)单胺氧化酶抑制剂(MAOI)可以减少嗜酸粒细胞的招募并保护免受隐球菌感染。未来的研究可以继续探索那些临床上批准使用的阻断血清素摄取以减少血小板缺乏血清素和5-HIAA的药物,或者阻断血清素代谢产生5-HIAA的药物,是否在减少嗜酸粒细胞的招募、诱导II型效应T细胞和隐球菌病方面具有疗效。这项研究的结果有助于深入理解嗜酸粒细胞在新型隐球菌感染中的作用机制,并为未来开发相关的治疗策略提供了潜在的靶点。然而,需要进一步人体内研究来验证这些发现,并评估相关治疗策略的安全性和有效性。
文献参考:
1.Brown, G.D., Denning, D.W., Gow, N.A., Levitz, S.M., Netea, M.G., and White, T.C. (2012). Hidden killers: human fungal infections. Sci. Transl.Med. 4, 165rv113. https://doi.org/10.1126/scitranslmed.3004404.
2.Iyer, K.R., Revie, N.M., Fu, C., Robbins, N., and Cowen, L.E. (2021).Treatment strategies for cryptococcal infection: challenges, advances and future outlook. Nat. Rev. Microbiol. 19, 454–466. https://doi.org/10.1038/s41579-021-00511-0.
3.Piehler, D., Stenzel, W., Grahnert, A., Held, J., Richter, L., Ko¨ hler, G.,Richter, T., Eschke, M., Alber, G., and Muller, U. (2011). Eosinophils contribute to IL-4 production and shape the T-helper cytokine profile and inflammatory response in pulmonary cryptococcosis. Am. J. Pathol.179, 733–744. https://doi.org/10.1016/j.ajpath.2011.04.025 .
4.Decken, K., Ko¨ hler, G., Palmer-Lehmann, K., Wunderlin, A., Mattner, F.,Magram, J., Gately, M.K., and Alber, G. (1998). Interleukin-12 is essential for a protective Th1 response in mice infected with Cryptococcus neoformans. Infect. Immun. 66, 4994–5000. https://doi.org/10.1128/IAI.66.10.4994-5000.1998
5.Blackstock, R., and Murphy, J.W. (2004). Role of interleukin-4 in resistance to Cryptococcus neoformans infection. Am. J. Respir. Cell Mol.Biol. 30, 109–117. https://doi.org/10.1165/rcmb.2003-0156OC .
6.De Giovanni, M., Tam, H., Valet, C., Xu, Y., Looney, M.R., and Cyster, J.G. (2022). GPR35 promotes neutrophil recruitment in response to serotonin metabolite 5-HIAA. Cell 185. 815.e19–830.e19. https://doi.org/10.1016/j.cell.2022.01.010

微信扫码在线客服