2023.7.14,来自北京大学基础医学院郑乐民教授团队在Advanced Science发表了题为“ L-Arginine-Loaded Gold Nanocages Ameliorate Myocardial Ischaemia/Reperfusion Injury by Promoting Nitric Oxide Production and Maintaining Mitochondrial Function ”的研究论文,设计、合成了负载L-精氨酸的硒包被金纳米笼(AAS),并用PCM (WLSEAGPVVTVRALRGTGSW)修饰得到AASP,其靶向心肌细胞,细胞摄取能力和体内外光声成像明显改善。
缺血性心脏病是全世界心血管疾病死亡的主要原因之一,冠状动脉狭窄或完全闭塞导致的急性心肌梗死是缺血性心脏病最常见的表现。心肌梗死后,受损的心肌最终会经历一个重塑过程,包括心肌细胞死亡、组织纤维化瘢痕和心肌扩张,最终导致心力衰竭。
虽然缺血心肌组织的再灌注治疗对病人的生存至关重要,但也会造成心肌缺血/再灌注(I/R)损伤,包括氧化损伤、细胞凋亡和炎症反应,针对这些影响仍然缺乏有效的临床治疗方案。
一氧化氮(NO)是一种多功能信号分子,在心血管稳态调节中起着重要作用。L-精氨酸(L-Arg)是在O 2 和NADPH存在下,由一氧化氮合酶催化合成的。 NO可以通过放松血管张力、抑制血小板聚集和调节炎症反应来降低MI/RI。NO抑制线粒体电子传递链中复合物I的活性,从而限制线粒体活性氧(ROS)的产生。 其进一步阻止了线粒体通透性过渡孔(mPTP)的打开,并减少了细胞色素c释放和心肌细胞凋亡。然而,在MI/RI发生时,心肌组织中过量的ROS会迅速与NO反应,产生过氧亚硝酸盐,从而进一步损害心肌组织。 因此,增强ROS抑制和NO生成是该治疗策略成功的关键。
硒(Se)具有新的抗氧化特性,是谷胱甘肽过氧化物酶的一种成分。Se缺乏会导致谷胱甘肽过氧化物酶活性显著降低,并导致氧化应激增加。Se纳米粒(Se NPs)因其高抗氧化活性、低毒性、易于修饰被广泛研究。研究表明11-巯基-1-十一醇修饰的Se NPs具有自由基清除活性,并拮抗顺铂引起的肾毒性。然而,关于Se NPs对MI/RI的保护作用知之甚少。 因此,设计用于MI/RI治疗的新型Se纳米复合材料意义重大。
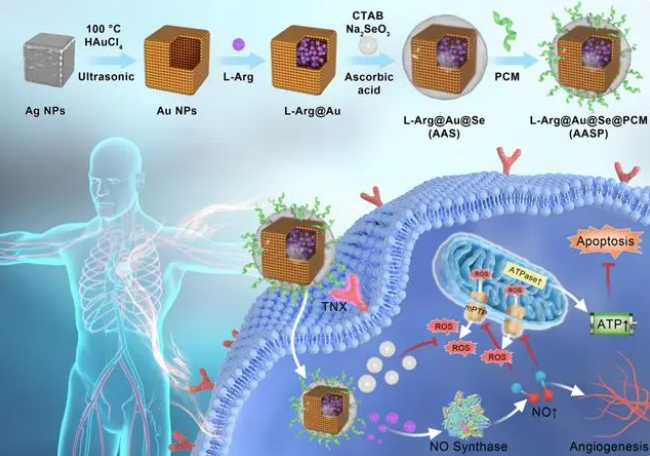
PCM修饰的硒包被金纳米笼合成路线及作用机制
该研究开发了一种心机靶向肽和L-精氨酸共修饰的硒金纳米笼(AASP)。纳米硒首先通过清除I/R损伤细胞中产生的ROS,为NO的释放提供了一个合适的环境,并防止其进一步氧化为过氧亚硝酸阴离子。然后,装载在金纳米笼中的L-精氨酸被释放,在一氧化氮合成酶的催化下产生NO,通过调节线粒体通透性转换孔(mTPP)的关闭来进一步阻止ROS的释放。因此,AASP通过清除ROS和产生NO的级联作用维持线粒体功能和能量供应,防止心肌细胞的氧化损伤。此外,AASP在体内给药不仅可以对大鼠心脏无创光声成像,还通过调节NO信号和抑制氧化损伤有效改善心肌功能、抑制心肌肥大和纤维化,最终改善大鼠的I/R损伤。AASP纳米制剂在治疗I/R损伤方面显示出显著的靶向传递和协同治疗潜力。

微信扫码在线客服