2024年2月1日,同济大学医学院王平课题组在Nature在线发表题为“7-Dehydrocholesterol dictates ferroptosis sensitivity”的最新论文,研究发现远端胆固醇合成途径中产生的中间甾醇7-DHC是一种新的铁死亡内源抑制因子,阐明了7-DHC依赖其5,7-不饱和双键的结构特性直接抑制磷脂过氧化的具体机制,提示甾醇与磷脂的过氧化在铁死亡过程中具有不同作用。
细胞程序性死亡(programmed cell death)是受到基因调控的有序的细胞死亡方式,其对生命体的发育、代谢、微环境稳态维持和疾病发生等过程至关重要,主要包括凋亡、程序性坏死和焦亡等形式。铁死亡是近年来鉴定的一种由铁依赖的磷脂过氧化引起的新型程序性细胞死亡形式,与细胞中多种代谢进程,如氨基酸代谢、铁代谢、磷脂代谢、辅酶Q10、谷胱甘肽合成等息息相关,并在肿瘤、器官缺血再灌注损伤和神经退行性疾病等多种疾病中发挥重要作用。解析铁死亡发生机制是细胞程序性死亡领域的前沿重大科学问题,并为治疗上述疾病带来了新的靶向策略。
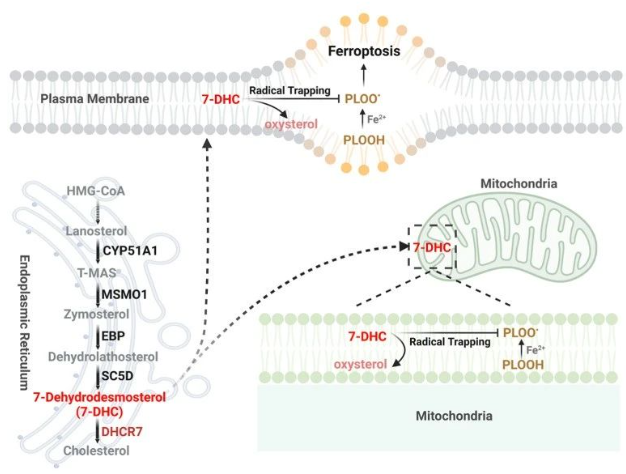
为了全面探究铁死亡的调控机制,王平教授团队首先通过全基因组CRISPR筛选技术,发现远端胆固醇合成通路关键酶能够差异调控铁死亡敏感性,他们通过内源敲除关键基因及外源回补不同中间代谢物等实验确定了远端胆固醇合成通路中的中间代谢物甾醇—7-脱氢胆固醇(7- Dehydrocholesterol)的水平直接影响细胞对铁死亡的敏感性。研究团队进一步对机制进行解析,通过FENIX等实验体系以及中间代谢物结构特征的对比,发现7-DHC依赖其B环中的5,7不饱和双键,以自身的氧化为代价直接抑制磷脂过氧化的发生,从而抑制铁死亡。有趣的是,他们发现麦角固醇(真菌中的主要甾醇形式)在B环中也存在5,7-不饱和双键,同样能够抑制磷脂过氧化及铁死亡的发生,提示这一类5,7-不饱和甾醇在抑制磷脂过氧化的功能上具有一定的普适性及保守性。
铁死亡参与癌症和器官缺血再灌注损伤疾病的发生发展,但在两种疾病中发挥着不同的功能。其中,诱导肿瘤细胞发生铁死亡能够作为癌症治疗的策略,而抑制机体细胞的铁死亡则可以作为保护器官损伤的策略。因此,通过靶向抑制远端胆固醇合成中关键酶来调控内源7-DHC的水平,可能成为临床治疗肿瘤或器官损伤的新靶标。在肿瘤治疗方面,作者首先通过对CRISPR筛选数据库分析发现,一些肿瘤细胞系的生存很可能依赖于7-DHC。进一步实验证明,抑制SU-DHL-8细胞中7-DHC的产生能够直接诱导铁死亡的发生,而小鼠水平的成瘤实验也证明靶向抑制7-DHC的产生能够在体诱导肿瘤细胞铁死亡并抑制肿瘤的生长。另一方面,通过药理学靶向抑制DHCR7可以有效在体积累7-DHC并治疗小鼠缺血再灌注肾损伤。
为代谢稳态维持与细胞命运决定之间的调控机制提供了新的理论依据,也为治疗肿瘤及缺血再灌注器官损伤等铁死亡密切相关疾病提供了潜在的靶点和策略。
文章来源:
Yaxu Li, Qiao Ran, Qiuhui Duan, Jiali Jin et al,7-Dehydrocholesterol dictates ferroptosis sensitivity.https://doi.org/10.1038/s41586-023-06983-9.

微信扫码在线客服