2024年6月26日,来自中国科学技术大学杨帆等合作在《中国药理学报》杂志上发表了标题为”Structural insights into somatostatin receptor 5 bound with cyclic peptides. “的研究成果,解析生长抑素受体5(SSTR5)与环肽结合的结构。
据介绍,SSTR5在分泌ACTH的垂体腺瘤中高度表达,是治疗库欣病的重要药物靶点。两种环状SST类似肽(帕西肽和奥曲肽)均能激活SSTR5和SSTR2。帕西肽比奥曲肽优先结合SSTR5,而奥曲肽比SSTR5更倾向于结合SSTR2。帕西肽和奥曲肽缺乏选择性会导致副作用,如高血糖、胃肠道紊乱和葡萄糖稳态异常。然而,对帕西肽和奥曲肽与SSTR5的结合和选择性机制知之甚少,限制了特异性靶向SSTR5亚型选择性SST类似物药物的开发。
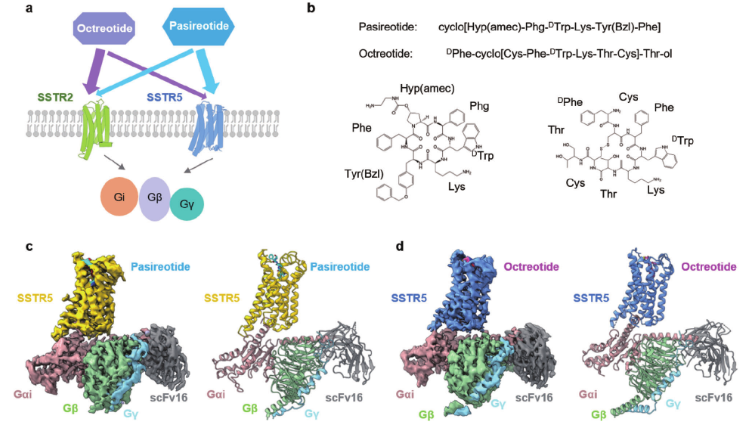
SSTR 5复合物的总体结构。
研究人员报道了帕西肽和奥曲肽分别以3.09?和3.24?的分辨率激活的SSTR5-Gi复合物的两种冷冻电镜(cryo-EM)结构。结合结构分析和功能实验,研究人员揭示了配体识别和受体激活的分子机制。帕西肽通过Tyr(Bzl)/DTrp和SSTR5之间的相互作用优先结合SSTR5。
此外,研究人员发现SSTR2的Q2.63、N6.55、F7.35和ECL2在奥曲肽偏向性结合SSTR2中起着至关重要的作用。
总之,这一研究结果将提供结构见解,并为针对特定SSTR亚型的更好选择性药物开发提供新的机会。
文章来源:
Li, Ying-ge, Meng, Xian-yu, Yang et al, Structural insights into somatostatin receptor 5 bound with cyclic peptides. DOI: 10.1038/s41401-024-01314-8, 《中国药理学报》 最新IF:8.2

微信扫码在线客服