【介绍】
间充质干细胞是一种成人多能干细胞,可分化为骨、软骨、脂肪和结缔组织。在过去的二十年中,由于其广泛的可塑性、免疫调节和抗炎特性,以及相对容易从脂肪组织、骨髓、脐带血和滑液中以患者特异性的方式分离出来,它们已成为再生医学中胚胎干细胞的一种广受欢迎的潜在替代品。在体外,它们已被反复证明能够生成各种非中胚层和非间充质组织,包括肝细胞、心肌细胞、胰腺细胞、神经元细胞和黑素细胞。它们的免疫调节能力使它们受欢迎,不仅因为它们为治疗以前难以治疗的疾病(如移植物抗宿主病和器官移植)带来了希望,而且因为与诱导多能干细胞(iPSC)和胚胎干细胞(ESC)衍生的组织相比,任何来自间充质干细胞的组织本身几乎不会引起免疫反应。 然而,尽管它们具有治疗潜力,但有一个主要的挫折:在体外,它们的增殖速率往往会急剧减慢,并且容易衰老,这使得它们难以扩增到足够的治疗用量。一些研究表明,调整培养基中的葡萄糖浓度可以减轻一些衰老,但这意味着在与临床无关的环境中培养细胞,这最终可能会改变它们的遗传稳定性。已经对2D细胞培养对表达模式的影响进行了研究,发现2D培养往往会导致细胞骨架和细胞核的整体扁平化,进而导致基因和基因表达的改变以及细胞外基质的重排。三维培养已被证明在维持细胞外基质微环境方面更为成功,并能产生更均匀、可重复的结果,在包括移植在内的临床应用中也取得了更多的成功。 OP9细胞是一种特征明确的小鼠骨髓基质细胞系,由于编码巨噬细胞集落刺激因子(M - CSF)的基因发生骨硬化突变,该细胞系不产生功能性M - CSF。OP9细胞最初用于与小鼠胚胎干细胞共培养,以诱导其分化为血细胞,但它们已被表征为间充质干细胞。在这里,我们讨论了在VitroGel 水凝胶系统上培养OP9的3D细胞培养,包括VitroGel 3D - RGD和新的VitroGel RGD - PLUS,它们含有不同水平的整合素结合配体修饰(RGD肽),用于不同的细胞 - 细胞和细胞 - 基质相互作用。(VitroGel 3D - RGD是一种即用型可调水凝胶系统,用RGD细胞粘附肽修饰,促进3D细胞培养期间的细胞附着和细胞 - 基质相互作用。VitroGel RGD - PLUS与常规VitroGel 3D - RGD相比,用3倍更高浓度的RGD肽修饰,即使在水凝胶稀释后也能保持高水平的整合素结合活性,支持需要强细胞 - 细胞和细胞 - 基质相互作用的细胞。) 材料和方法 细胞培养 OP9细胞在添加了10%FBS和1x pen - strep的α - z低必需培养基中维持培养。当培养物达到80 - 90%汇合时进行传代。对于2D水凝胶涂层培养和3D细胞培养,根据用户手册,使用VitroGel 3D - RGD和VitroGel RGD - PLUS,如下所述。 2D涂层培养方法 用VitroGel稀释溶液(类型1)以1:0、1:1和1:3的稀释度制备2D涂层水凝胶,然后与无细胞的OP9培养基以4:1的比例混合;向每个24孔板中加入300μl。水凝胶在室温下稳定20分钟,然后将细胞添加到悬浮在300μl覆盖培养基中的水凝胶顶部。每隔一天更换培养基。 3D涂层培养方法 根据制造商的方案,用VitroGel稀释溶液(类型1)以1:3的稀释度制备水凝胶。对于共聚焦/荧光成像,使用底部有盖玻片的8孔室培养细胞,每孔使用200μl水凝胶。每隔一天更换培养基。 免疫荧光(IF)成像 由于细胞具有GFP报告基因,我们进行了活细胞成像。使用具有z堆栈功能的Leica TCS SP8扫描共聚焦显微镜在10X和20X放大倍数下拍摄图像,并通过LAS X软件和ImageJ进行处理。使用LAS X软件和ImageJ进行图像的处理和分析。
【结果】
在2D VitroGel培养中,OP9细胞表现出细胞聚集和健康的细胞形态。 我们在原始的VitroGel 3D - RGD和新的VitroGel RGD - PLUS中评估了2D培养中的OP9细胞。在组织培养板表面的标准2D培养中,OP9细胞与许多间充质细胞类型一样,采用成纤维细胞样形状,并且无法聚集(图1A)。在这种环境中,间充质干细胞增殖不佳,可能导致衰老。此外,它们在细胞培养中表现出与凋亡阶段通常相关的特征性亮点。为了了解在我们的可调系统中OP9培养的z佳条件,我们在VitroGel的各种稀释液中培养这些细胞。在VitroGel 3D - RGD中(图1B - D),仅在细胞培养2天后,细胞在所有稀释度下都形成聚集。对于更新的VitroGel RGD - PLUS(图1E - G),细胞更加健壮,在z低稀释度下形成大的集落并表现出健康的MSC形态。
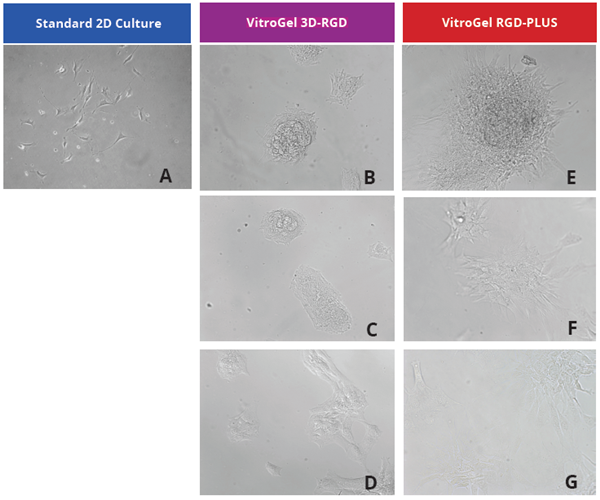
图1:OP9 - GFP细胞在VitroGel 3D - RGD和VitroGel RGD - PLUS的2D水凝胶涂层表面上生长。与标准2D培养(A)相比,OP9细胞在仅培养2天后在3D VitroGel环境中(B - G)附着和聚集得更好。在两种VitroGel产品中,细胞在1:0稀释度下显示聚集(B,E),但在较低的凝胶强度物质下,细胞在VitroGel RGD - PLUS上扩散和附着得更好。
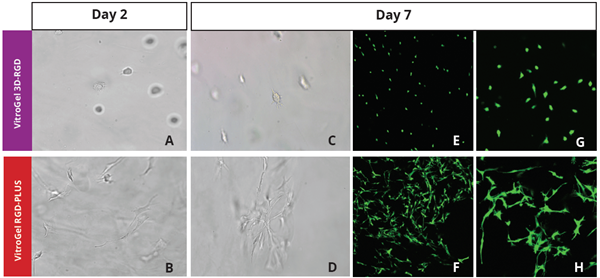
图2:OP9 - GFP细胞在VitroGel 3D - RGD和VitroGel RGD - PLUS中的三维培养。虽然VitroGel 3D - RGD促进细胞扩增(E,G),但新的VitroGel RGD - PLUS对OP9细胞增殖和细胞 - 细胞通信有更好的支持。
更强的细胞 - 基质相互作用帮助细胞形成细胞网络结构(F,H)。(图像A,B,C,D,G,H在20X;图像E&F在10X)。 E的3D视图 G的3D视图 F的3D视图 H的3D视图 在VitroGel RGD - PLUS中培养OP9细胞促进细胞间网络的构建 这种特征在二维培养中通常是不可能的,并且在三维培养中可能会有所不同。为了了解我们的水凝胶系统是否能够促进这一点,我们在三维培养中用我们的两种水凝胶培养OP9细胞。根据我们之前的经验,对于3D细胞培养,OP9细胞更喜欢在软的水凝胶基质(G’ < 300 Pa)中生长。因此,本研究选择了1:3稀释的稀释VitroGel水凝胶。体内3D微环境的一个主要因素是细胞形成细胞间网络的能力。在VitroGel 3D - RGD中,培养7天后,细胞已沉淀到3D水凝胶中(图2C,E,G)。细胞是活的,但根据第2天和第7天的图像比较,增殖速率较低(图2A&C)。图2E和G的3D视图显示,在常规VitroGel 3D - RGD中培养7天后,OP9细胞缺乏细胞间连接。另一方面,在VitroGel RGD - PLUS中培养的细胞表现出更多的3D成纤维细胞样形态,并形成了广泛的细胞间连接(图2D,F,H;图2F和H的3D视图)。
【讨论】
我们的研究表明,我们的新VitroGel RGD - PLUS可以成为依赖细胞间网络的细胞应用的理想三维支架。细胞分化和身份由复杂的细胞 - 细胞通信调节,这只能通过可扩散配体在短距离内实现;这种行为在体外难以模拟。它可能导致体外和体内研究之间的变异性,从而阻碍转化研究。 对于组织再生,特别是间充质分化,与周围细胞通信的能力是绝对必要的。细胞通信通常通过细胞间的可扩散因子在相对短的距离内发生,这得益于三维环境提供的紧密接触。然而,更长距离的信号需要细胞通信网络。多项研究表明,不同种类的支架和不同的弹性可以驱动分化沿着不同的途径进行。VitroGel系统提供了一个足够可调的平台,以适应任何应用,减少变异性并简化过程。
【参考文献】
1.Ullah, I., Subbarao, R. B. & Rho, G. J. Human mesenchymal stem cells – current trends and future prospective. Biosci. Rep. 35, 1–18 (2015).
2.Stock, P. et al. The generation of hepatocytes from mesenchymal stem cells and engraftment into murine liver. Nat Protoc 5, 617–627 (2010).
3.Itaba, N. et al. Hepatic cell sheets engineered from human mesenchymal stem cells with a single small molecule compound IC-2 ameliorate acute liver injury in mice. Regen Ther 9, 45–57 (2018).
4.Arslan, Y. E., Galata, Y. F., Sezgin Arslan, T. & Derkus, B. Trans-differentiation of human adipose-derived mesenchymal stem cells into cardiomyocyte-like cells on decellularized bovine myocardial extracellular matrix-based films. J Mater Sci Mater Med 29, 127 (2018).
5.Belame Shivakumar, S. et al. Pancreatic endocrine-like cells differentiated from human umbilical cords Wharton’s jelly mesenchymal stem cells using small molecules. J. Cell. Physiol. 234, 3933–3947 (2019).
6.Srivastava, A. et al. Secretome of Differentiated PC12 Cells Enhances Neuronal Differentiation in Human Mesenchymal Stem Cells Via NGF-Like Mechanism. Mol. Neurobiol. 55, 8293–8305 (2018).
7.Paino, F. et al. Ecto-mesenchymal stem cells from dental pulp are committed to differentiate into active melanocytes. Eur Cell Mater 20, 295–305 (2010).
8.Jia, Z. et al. Isolation and characterization of human mesenchymal stem cells derived from synovial fluid by magnetic-activated cell sorting (MACS). Cell Biol. Int. 42, 262–271 (2018).
9.Amati, E. et al. Generation of mesenchymal stromal cells from cord blood: evaluation of in vitro quality parameters prior to clinical use. Stem Cell Research & Therapy 2017 8:1 8, 14 (2017).
10.Baer, P. C. Adipose-derived mesenchymal stromal/stem cells: An update on their phenotype in vivo and in vitro. World J Stem Cells 6, 256–265 (2014).
11.Gao, F. et al. Mesenchymal stem cells and immunomodulation: current status and future prospects. Cell Death & Disease 7, e2062 (2016).
12.McKee, C. & Chaudhry, G. R. Advances and challenges in stem cell culture. Colloids Surf B Biointerfaces 159, 62–77 (2017).
13.Li, Y.-M. et al. Effects of high glucose on mesenchymal stem cell proliferation and differentiation. Biochem. Biophys. Res. Commun. 363, 209–215 (2007).
14.Nakano, T., Kodama, H. & Honjo, T. Generation of lymphohematopoietic cells from embryonic stem cells in culture. Science 265, 1098–1101 (1994).
15.Gao, J. et al. Characterization of OP9 as authentic mesenchymal stem cell line. J Genet Genomics 37, 475–482 (2010).
16.Thurley, K., Wu, L. F. & Altschuler, S. J. Modeling Cell-to-Cell Communication Networks Using Response-Time Distributions. Cell Syst 6, 355–367.e5 (2018).

微信扫码在线客服