【介绍】
胶质母细胞瘤是一种发生在大脑或脊髓的侵袭性癌症。多年来,为了帮助理解胶质母细胞瘤的发病机制和进展,人们开发了各种胶质母细胞瘤模型。然而,由于促进这种疾病的遗传和环境因素多种多样且复杂,以及其起源组织的不确定性,这一过程变得复杂。 胶质母细胞瘤的治疗也很难开发,因为二维培养系统无法模拟肿瘤微环境。肿瘤的进展关键取决于肿瘤细胞与其微环境之间的相互作用。肿瘤微环境是异质和动态的;它由细胞外基质、基质细胞、免疫细胞、祖细胞、血管和淋巴管组成,这在二维环境中是不可能重现的。各种研究表明,在二维环境中培养的肿瘤细胞在细胞增殖能力、抗凋亡能力、分化能力、侵袭能力甚至生物标志物表达方面表现出明显的差异。此外,仅仅研究肿瘤来源的细胞是不够的;肿瘤本质上是三维的,这种形态在肿瘤进展中起着作用,即血管生成,这是恶性肿瘤的关键因素。此外,在胶质母细胞瘤中发现了具有类似干细胞特性的癌细胞,它们被认为是导致对常规治疗的高抗性和高复发率的原因。因此,准确有效地开发胶质母细胞瘤的治疗方法将需要三维模型,这些模型能够紧密模拟三维肿瘤中表现出的细胞 - 细胞相互作用。 U - 87 MG细胞是一种人类原发性胶质母细胞瘤细胞系,常用于研究胶质母细胞瘤的因果关系和进展。在这里,我们讨论使用我们的二维和三维VitroGel可调支架培养这些细胞的生长情况。 材料和【方法】
细胞培养
U - 87 MG细胞在添加了10%FBS和1x pen - strep的Eagle最低必需培养基中维持培养。当培养物达到80 - 90%汇合时进行传代。对于2D水凝胶涂层培养和3D细胞培养,根据用户手册,使用VitroGel 3D - RGD和VitroGel RGD - PLUS,如下所述。
2D涂层培养方法
用VitroGel稀释溶液(类型1)以1:0、1:1和1:3的稀释度制备2D涂层水凝胶,然后与无细胞的U - 87 MG培养基以4:1的比例混合;向每个24孔板中加入300μL。水凝胶在室温下稳定20分钟,然后将细胞添加到悬浮在300μL覆盖培养基中的水凝胶顶部。每隔一天更换培养基。
3D涂层培养方法
根据制造商的方案,用VitroGel稀释溶液(类型1)以1:1和1:3的稀释度制备水凝胶。对于共聚焦/荧光成像,使用底部有盖玻片的8孔室培养细胞,每孔使用200μL水凝胶。每隔一天更换培养基。 免疫
荧光(IF)成像
对于IF成像,细胞在有盖玻片的腔室载玻片上生长,而不是在8孔板上。每个腔室容纳200μL水凝胶/细胞混合物。根据制造商的方案,使用Image - iT?固定/透化试剂盒、ActinGreen?488 ReadyProbes?试剂和NucBlue?固定细胞ReadyProbes?试剂(ThermoFisher)对细胞进行固定和染色。使用带有ZEN软件和ImageJ的Zeiss Axiovert 200M荧光细胞成像显微镜拍摄图像。
【结果】
在2D VitroGel系统上培养U - 87 MG细胞促进球体形态的形成。 为了研究我们的2D VitroGel系统是否有利于U - 87 MG细胞在二维系统中的生长,我们在我们的两种VitroGel产品的各种稀释液中培养它们。U - 87 MG细胞从人类胶质母细胞瘤肿瘤中收获,尽管在标准的2D培养中它们的固有性质是聚集,但它们采用成纤维细胞样形态,仅形成小聚集体(图1A)。在VitroGel水凝胶中,细胞表现出更多的球体聚集,即使在较低的稀释度下(图1B - E)。在两种水凝胶的1:3稀释度下(图1C,E),形成的集落较小,但在新的更软的VitroGel RGD - PLUS中,细胞聚集体表现出一种有趣的形态特征:它们在聚集体之间形成桥梁(图1E)。
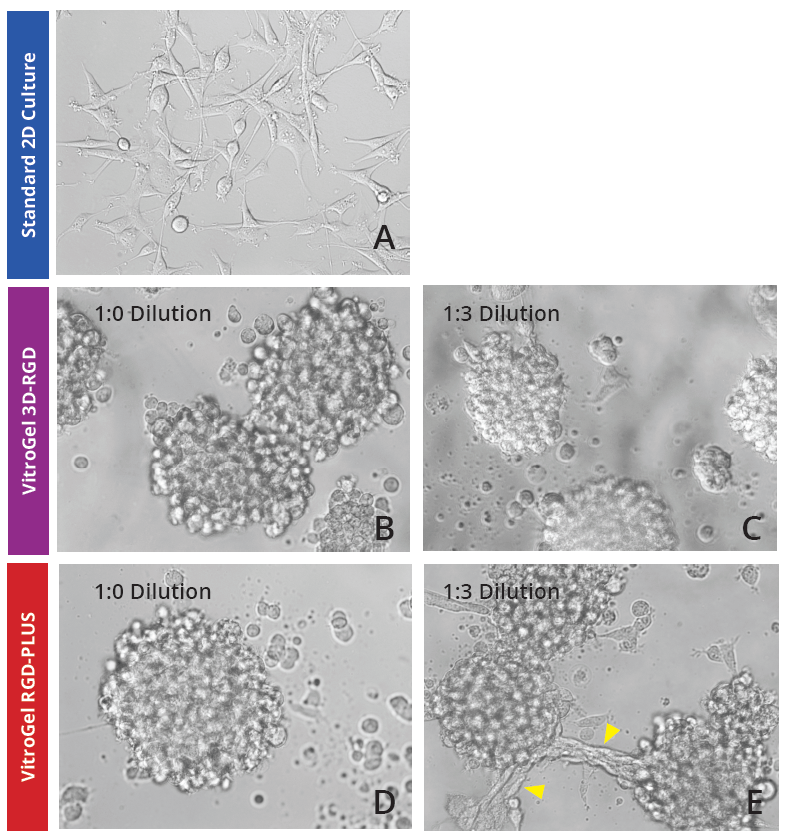
图1:U - 87 MG细胞在VitroGel 3D - RGD和VitroGel RGD - PLUS的2D水凝胶厚涂层表面上生长2天。在1:0稀释度下,细胞在两种水凝胶的表面聚集形成球体(B,C)。在1:3稀释度下(C,E),柔软的物质有助于细胞在VitroGel RGD - PLUS表面的不同球体之间建立连接(黄色箭头)。 VitroGel RGD - PLUS在3D培养7天后促进细胞间网络的发展 为了进一步研究VitroGel RGD - PLUS促进细胞间网络形成的能力,我们在不同稀释度的三维培养中培养U - 87 MG细胞。我们发现,在原始VitroGel 3D - RGD的两种浓度下,细胞都可以在水凝胶中沉淀和生长(第2天,图2A - B),但在7天后(图2D - E),它们的总体扩散没有改变,它们可以形成簇状结构,但没有表现出细胞间网络连接(图2E)。在VitroGel RGD - PLUS中,细胞不仅在第2天就沉淀到水凝胶中,而且它们表现出与VitroGel 3D - RGD中细胞明显不同的形态:它们更长,并开始建立细胞间网络。7天后,它们在3D水凝胶中表现出广泛的细胞 - 细胞连接(图2H - I),其簇比VitroGel 3D - RGD中的簇大得多(图2J)。
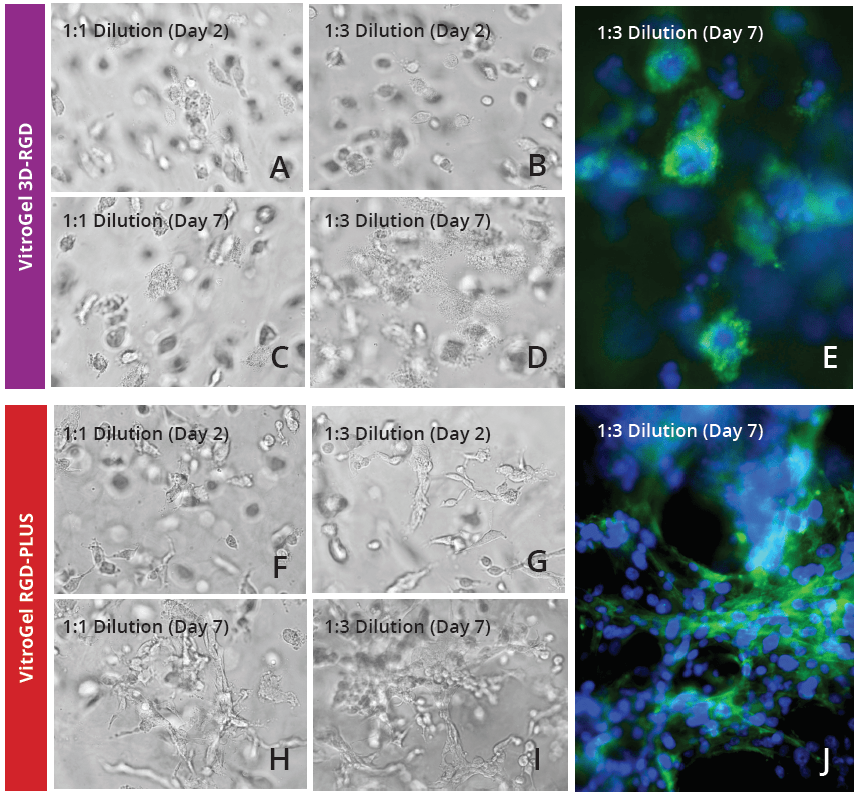
图2:U - 87 MG细胞在VitroGel 3D - RGD和VitroGel RGD - PLUS中培养。细胞可以在两种水凝胶的1:1和1:3稀释度的3D水凝胶中生长。细胞在VitroGel 3D - RGD中融入水凝胶(A - D),但无法形成网络连接(E)。然而,在新的VitroGel RGD - PLUS中,细胞在2天后融入(F - G),但在第7天能够形成细胞间肌动蛋白连接(H - J)。
【讨论】
与VitroGel 3D - RGD中的球体结构不同,U - 87 MG细胞在VitroGel RGD - PLUS中创建更好的细胞网络结构,表明更好的细胞 - 细胞和细胞 - 基质相互作用。这些相互作用是正确重现体内组织组织和再生以及体外癌症的关键部分。尽管这一点得到了认可,但研究人员发现很难解决这个问题,因为这个问题不仅仅有一种解决方案。例如,在标准的体内细胞生态位中,存在各种类型的细胞相互作用、形状、连接等。对现有三维支架的研究表明,驱动组织表面张力从而影响细胞命运的细胞间凝聚力在组织的不同部分之间可能会有很大差异。考虑到一些三维基质更适合某些细胞类型而不适合其他细胞类型,这会给试图使用三维细胞培养方法的研究带来一定程度的变异性,这可能会成为问题。即使在我们自己的研究中,这一点也很明显。我们看到,相同基质的不同浓度可能导致不同的细胞行为,即使细胞能够在所有浓度下生长。 产生适当的细胞外基质相互作用的能力也将是正确理解肿瘤微环境的关键部分。大量的癌症进展是由于肿瘤细胞与周围环境相互作用的能力。例如,在肿瘤生长期间,转移过程始于氧气和营养物质的剥夺,这会触发血管生成生长因子和细胞因子的释放,从而导致血管生成。这种营养和氧气剥夺只有在达到一定的生长阈值后才会发生,而这在二维培养中是无法实现的,并且需要适当的细胞 - 细胞和细胞 - 基质相互作用才能实现体内建模。 我们的研究和其他研究表明,一个更可调的系统最终可能最有希望在体外真正模拟体内系统。器官再生的未来将需要开发能够捕捉体内细胞外基质特性复杂性的平台,同时也能够调整基质特性,为组织内的各种细胞提供体内环境。未来的癌症研究将依赖于一个三维可调系统,该系统将真实地代表实体瘤的生长,并将真实地重现肿瘤对假定治疗的反应。以前对VitroGel可调水凝胶的研究表明,它们是药物测试的可行选择,各种研究已经证明了这种水凝胶在癌症研究中的成功。新的VitroGel RGD - PLUS中细胞网络能力的增强表明,这种新的基质可能为癌症和再生医学研究提供可行的解决方案。
【参考文献】
Kutwin, M. et al. Investigation of platinum nanoparticle properties against U87 glioblastoma multiforme. Arch Med Sci 13, 1322–1334 (2017).
Liu, H. et al. Differentiation of human glioblastoma U87 cells into cholinergic neuron. Neurosci. Lett. 704, 1–7 (2019).
Miyai, M. et al. Current trends in mouse models of glioblastoma. J. Neurooncol. 135, 423–432 (2017).
Wu, M. & Swartz, M. A. Modeling tumor microenvironments in vitro. J Biomech Eng 136, 021011 (2014).
Stock, K. et al. Capturing tumor complexity in vitro: Comparative analysis of 2D and 3D tumor models for drug discovery. Sci Rep 6, 28951 (2016).
Riedl, A. et al. Comparison of cancer cells in 2D vs 3D culture reveals differences in AKT-mTOR-S6K signaling and drug responses. J. Cell. Sci. 130, 203–218 (2017).
Amann, A. et al. Development of a 3D angiogenesis model to study tumour – endothelial cell interactions and the effects of anti-angiogenic drugs. Sci Rep 7, 2963 (2017).
Murat, A. et al. Stem cell-related ‘self-renewal’ signature and high epidermal growth factor receptor expression associated with resistance to concomitant chemoradiotherapy in glioblastoma. J. Clin. Oncol. 26, 3015–3024 (2008).
Oh, S.-J. et al. Human U87 glioblastoma cells with stemness features display enhanced sensitivity to natural killer cell cytotoxicity through altered expression of NKG2D ligand. Cancer Cell Int. 17, 22 (2017).
Hansen, N. U. B., Genovese, F., Leeming, D. J. & Karsdal, M. A. The importance of extracellular matrix for cell function and in vivo likeness. Exp. Mol. Pathol. 98, 286–294 (2015).
Manning, M. L., Foty, R. A., Steinberg, M. S. & Schoetz, E.-M. Coaction of intercellular adhesion and cortical tension specifies tissue surface tension. Proc. Natl. Acad. Sci. U.S.A. 107, 12517–12522 (2010).
Melissaridou, S. et al. The effect of 2D and 3D cell cultures on treatment response, EMT profile and stem cell features in head and neck cancer. Cancer Cell Int. 19, 16 (2019).
Voss, M. J., Niggemann, B., Z?nker, K. S. & Entschladen, F. Tumour reactions to hypoxia. Curr. Mol. Med. 10, 381–386 (2010).
Mimeault, M. & Batra, S. K. Hypoxia-inducing factors as master regulators of stemness properties and altered metabolism of cancer- and metastasis-initiating cells. J. Cell. Mol. Med. 17, 30–54 (2013).
Foty, R. A. & Steinberg, M. S. Differential adhesion in model systems. Wiley Interdiscip Rev Dev Biol 2, 631–645 (2013).
Mahauad-Fernandez, W. D. & Okeoma, C. M. B49, a BST-2-based peptide, inhibits adhesion and growth of breast cancer cells. Sci Rep 8, 4305 (2018).
Li, X., Seebacher, N. A., Xiao, T., Hornicek, F. J. & Duan, Z. Targeting regulation of cyclin dependent kinase 9 as a novel therapeutic strategy in synovial sarcoma. J. Orthop. Res. 37, 510–521 (2019).
Akamandisa, M. P., Nie, K., Nahta, R., Hambardzumyan, D. & Castellino, R. C. Inhibition of mutant PPM1D enhances DNA damage response and growth suppressive effects of ionizing radiation in diffuse intrinsic pontine glioma. Neuro-oncology (2019). doi:10.1093/neuonc/noz053
Mahauad-Fernandez, W. D. et al. BST-2 promotes survival in circulation and pulmonary metastatic seeding of breast cancer cells. Sci Rep 8, 17608 (2018).

微信扫码在线客服