解析文章:《Conservation of an immune homeostasis module in land plants》
作者:Ruoqi Dou 1 , Karima El Mahboubi 2 , Cailun A.S. Tanney 1 , Jiashu Chu 3,a , Melissa Bredow 1 , Maria Camila Rodriguez Gallo 4 , Dominique Lauressergues 2 , Jean Keller 2 , Virginia Natali Miguel 1 , Thomas A. DeFalco 3,b , R. Glen Uhrig 4,5 , Cyril Zipfel 3, Pierre-Marc Delaux 2 , and Jacqueline Monaghan 1,*
背景
该文章探讨了植物中CPK28-PUB25/26-BIK1模块的保守性及其在植物免疫稳态中的作用。CPK28是一种钙依赖型蛋白激酶,已知在多种植物中调控免疫稳态和生长发育。文章特别关注了在陆生植物中,该模块如何进化并保守地调控植物的免疫反应。
方法
植物材料:
拟南芥:用于功能互补实验,检测MPCPK28在拟南芥中的功能。
地钱(Marchantia polymorpha):作为非血管植物的模型,研究CPK28及其相关蛋白的进化和功能。
烟草(Nicotiana benthamiana):用于蛋白亚细胞定位的瞬时表达实验。
基因克隆与表达:
通过分子克隆技术构建各种表达载体,包括MPCPK28、MPPBLa、MPPUB20e等基因的过表达载体。使用Golden Gate、Gateway、In-Fusion、Gibson Assembly等多种克隆方法。
蛋白纯化与体外激酶实验:
从大肠杆菌中纯化带有His标签或GST标签的重组蛋白。使用Tymora Analytical品牌的pIMAGO HRP Detection on Western Blot试剂盒(货号:800-40)检测激酶活性。
细胞降解实验与泛素化实验:
在体外进行细胞降解实验,检测MPPBLa和AtBIK1的蛋白降解情况。进行泛素化实验,验证MPPUB20e对MPPBLa的泛素化作用。
磷酸化蛋白组学分析:
对地钱蛋白提取物进行磷酸化蛋白组学分析,鉴定MPCPK28的磷酸化底物。
植物表型分析:
观察MPCPK28过表达地钱植株的表型变化,包括生长发育和免疫反应。
在拟南芥中进行互补实验,观察MPCPK28对cpk28-1突变体表型的恢复作用。
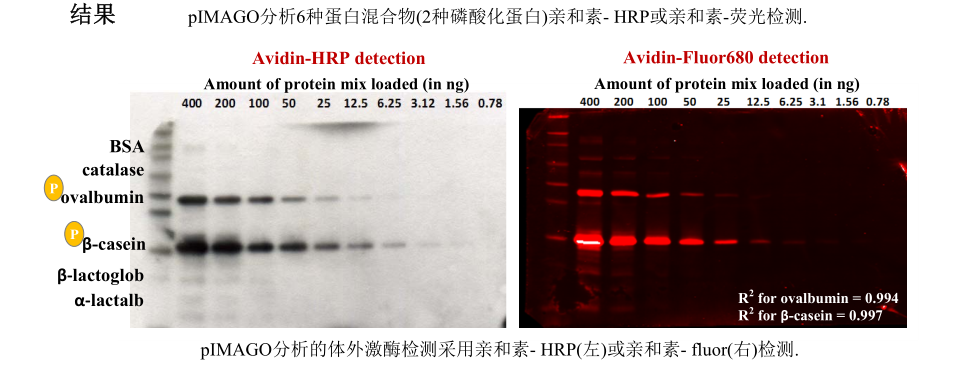
实验介绍 - Tymora Analytical品牌的pIMAGO HRP Detection on Western Blot试剂盒
产品作用:
Tymora Analytical品牌的pIMAGO HRP Detection on Western Blot试剂盒(货号:800-40)是一种用于Western Blot检测的高灵敏度试剂盒。它结合了酶联免疫吸附测定(ELISA)的高灵敏度和传统Western Blot的特异性,能够检测低丰度蛋白的磷酸化状态。该试剂盒特别适用于检测激酶活性实验中的磷酸化底物,能够清晰、准确地显示蛋白的磷酸化水平。
高灵敏度:
pIMAGO试剂盒采用先进的化学发光技术,能够在低丰度蛋白存在的情况下提供清晰的信号,使得激酶活性检测更加准确可靠。在研究低丰度或短寿命的磷酸化蛋白时,pIMAGO试剂盒能够显著提高检测灵敏度,避免假阴性结果。
特异性:
试剂盒中的抗体经过严格筛选和优化,能够特异性地识别目标蛋白的磷酸化位点,减少非特异性结合带来的背景干扰。结合传统Western Blot的特异性,pIMAGO试剂盒能够准确反映蛋白的磷酸化状态,为激酶活性研究提供有力支持。
操作简便:
试剂盒提供了完整的操作指南和配套试剂,用户只需按照指南逐步操作即可完成实验。
无需复杂的实验步骤或昂贵的仪器设备,适用于各种实验室环境。
广泛应用:
pIMAGO试剂盒不仅适用于激酶活性检测,还可用于其他需要高灵敏度Western Blot检测的实验场景。在信号转导、细胞周期调控、癌症研究等领域具有广泛应用前景。
应用:
在本文中,pIMAGO试剂盒被用于检测MPCPK28的激酶活性及其底物的磷酸化状态。通过纯化MPCPK28及其底物蛋白(如MPPBLa和MPPUB20e),在体外进行激酶反应,并使用pIMAGO试剂盒检测底物的磷酸化水平。实验结果表明,MPCPK28能够磷酸化MPPBLa和MPPUB20e等多个底物,且磷酸化位点在进化上高度保守。这些结果为揭示CPK28-PUB25/26-BIK1模块在陆生植物中的保守性和功能提供了重要证据。
结论
文章通过一系列实验证明了CPK28-PUB25/26-BIK1模块在陆生植物中的保守性及其在免疫稳态调控中的重要作用。主要结论包括:
MPCPK28的功能保守性:
MPCPK28在地钱中显示出与拟南芥AtCPK28相似的激酶活性和功能,能够调控地钱的免疫稳态和生长发育。
底物的磷酸化调控:
MPCPK28能够磷酸化多个底物蛋白,包括MPPBLa和MPPUB20e等,这些底物的磷酸化在进化上高度保守。
模块的保守性:
CPK28-PUB25/26-BIK1模块在陆生植物中广泛存在且功能保守,对于维持植物的免疫稳态具有重要意义。
进化意义:
该模块在陆生植物进化过程中可能起到了关键的调控作用,有助于植物适应不同的生态环境和微生物群落。
综上所述,文章通过深入研究CPK28-PUB25/26-BIK1模块的保守性和功能,为揭示植物免疫稳态的调控机制提供了新的视角和线索。Tymora Analytical品牌的pIMAGO HRP Detection on Western Blot试剂盒在实验中发挥了重要作用,为准确检测蛋白磷酸化状态提供了有力支持。

Tymora品牌 pIMAGO?-biotin Phosphoprotein Detection Kit
For Western Blot HRP-based detection(ECL)
货号:800-40 无需抗体的磷酸化蛋白检测试剂盒
pIMAGO是一种通用的磷酸化蛋白检测技术,能够对磷酸化分子进行敏感和特异性的识别。与磷酸化抗体不同,该结合不受氨基酸序列的影响,因此可用于检测任何蛋白质位点上的任何磷酸化发生。pIMAGO检测方案类似于一个简单的Western Blot,简单、便捷、高效。


微信扫码在线客服