PNGase F,也称为肽N-糖苷酶F,是一种在分子生物学和生物化学研究中常用的酶。它在研究糖蛋白方面发挥着重要作用,糖蛋白是附着有糖分子(糖链)的蛋白质。PNGase F用于从糖蛋白中移除N-连接的糖链,使其成为各种科学应用中的重要工具。
PNGase F的使用:
糖蛋白去糖基化:PNGase F酶促地从糖蛋白中切割N-连接的糖链。N-连接的糖链是一种特定类型的糖链,它附着在蛋白质氨基酸序列中的天冬酰胺(N)残基上。
在糖蛋白分析中的重要性:从糖蛋白中移除糖链对于研究其底层蛋白质结构和功能至关重要。它允许研究人员分析蛋白质核心,准确确定其分子量,并研究其生物活性。
应用:PNGase F在各种应用中广泛使用,包括蛋白质组学、结构生物学、免疫学和药物研究。它在表征糖蛋白、理解它们在细胞过程中的作用以及开发治疗药物方面发挥着重要作用。
生物医学研究:在生物医学研究中,PNGase F用于分析与癌症、糖尿病和传染病等疾病相关的糖蛋白。它有助于识别生物标志物和潜在的药物靶标。
质量控制:在生物制药行业中,PNGase F被用来确保基于糖蛋白的药物(如单克隆抗体)的质量和一致性,通过验证糖链结构和监测糖基化模式。
糖蛋白工程:研究人员可以使用PNGase F对糖蛋白进行特定目的的修改,例如提高药物效果或改变糖链结构,用于研究或治疗应用。
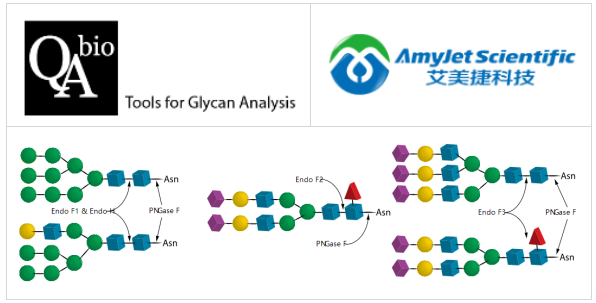
Endo F1、Endo F2、Endo F3、Endo H和PNgase F的活性比较
艾美捷QA-Bio-PNGase F内容:
PNGase F 在 20 mM Tris-HCl,pH 7.5
随附20 uL 和 60 uL 包装大小:
5倍反应缓冲液 7.5 – 250 mM 磷酸钠,pH 7.5
变性溶液 – 2% SDS,1 M β-巯基乙醇
Triton X-100 – 15% 溶液
比活性 >25 U/mg
活性 5 U/ml
分子量 35,000 道尔顿
pH 范围 6-10,Z佳 pH 7.5
QA-Bio-PNGase F 协议:
向 Eppendorf 管中添加最多 200 ?g 的糖蛋白。用去离子水调整至 35 ?l 的最终体积。
添加 10 ?l 的 5倍反应缓冲液 7.5 和 2.5 ?l 的变性溶液。在 100°C 下加热 5 分钟。
冷却。添加 2.5 ul 的 Triton X-100 并混合。
向反应中添加 2.0 ul 的酶。在 37°C 下孵育 3 小时。
特异性 切割所有天冬酰胺连接的复杂型、混合型或高甘露糖寡糖,除非是α(1-3)核心岩藻糖化的;天冬酰胺必须在两端都有肽键,无Endo F
比活性 定义为在 37°C,pH 7.5 的条件下,每分钟催化 1 微摩尔变性的牛胰核糖核酸酶 B 释放 N-连接寡糖所需的酶量。通过 SDS-PAGE 监测切割(切割后的牛胰核糖核酸酶 B 迁移更快)。
QA-Bio-PNGase F文献参考:
Bayer, E.A., F. De Meester, T. Kulik and M. Wilchek. Preparation of deglycosylated egg white avidin. Appl Biochem Biotech 53: 1-9 (1995)
Elder, J.H. and S. Alexander. Endo-b-N-Acetylglucosaminidase F: endoglycosidase from Flavobacterium meningosepticum that cleaves both high-mannose and complex glycoproteins. Proc Natl Acad Sci USA 79: 4540-4544 (1982)
Tarentino, A .L., C.M. Gomez and T.H. Plummer, Jr. Deglycosylation of asparagine-linked glycans by peptide :N-glycosidase F. Biochemistry 24: 4665-4671 (1985)
Tarentino A.L. and T.H. Plummer. Enzymatic deglycosylation of asparagine -linked glycans: purification, properties, and specificity of oligosaccharide-cleaving enzymes from Flavobacterium meningosepticum. Meth Enzymol 230: 44-57 (1994)
Trimble R.B. and A.L. Tarentino. Identification of distinct endoglycosidase (endo) activities in Flavobacterium meningosepticum: endo F1 , endo F2 and endo F3. Endo F1 and endo H hydrolyze only high mannose and hybrid glycans. J Biol Chem 266: 1646-1 651 (1991)
Taga, E. M., A. Waheed and R. L. Van Etten. Structural and chemical characterization of a homogeneous peptide-N-glycosidase from almond. Biochemistry 23: 815-22 (1984)
Tarentino AL, Trimble RB, Plummer TH. Enzymatic approaches for studying the structure, synthesis, and processing of glycoproteins. Methods in Cell Biology: 32: 111–39 (1989)
Anthony L. , Tarentino and Thomas H. Plummer Jr. Enzymatic deglycosylation of asparagine-linked glycans: Purification, properties, and specificity of oligosaccharide-cleaving enzymes from Flavobacterium meningosepticum. Methods in Enzymology: 230: 44-57. (1994)
Tarentino AL, Plummer TH. Oligosaccharide accessibility to peptide:N-glycosidase as promoted by protein-unfolding reagents. The Journal of Biological Chemistry. 257 (18): 10776–80. (1982)
艾美捷科技是QA-Bio的中国代理商,为科研工作者提供优质的产品与服务。

微信扫码在线客服