引言
谷氨酸是大脑中最重要的兴奋性神经递质。许多不同类型的离子型和代谢型受体介导其对神经元的刺激信号。但是,就像开关一样,“关闭”信号和“开启”信号同样重要。兴奋性氨基酸转运体(EAATs)家族通过将谷氨酸回收回神经元和星形胶质细胞,迅速从突触间隙和周围细胞外空间中移除谷氨酸,从而帮助终止谷氨酸的兴奋信号。通过这种方式,EAATs管理:
1、维持谷氨酸信号的时间保真度。通过从突触间隙中移除谷氨酸,它们防止了初始信号发送后对突触后受体的过度刺激,这会损害对下一个到达信号的检测。
2、维持信号的空间保真度,防止谷氨酸从其释放的突触中“逃逸”,并刺激意外的突触外或突触谷氨酸受体。
3、保护神经元免受细胞外空间中过量谷氨酸的毒性作用。谷氨酸受体的加剧或持续激活启动了一系列神经毒性反应,最终导致神经元功能丧失和细胞死亡,这被称为兴奋毒性。
谷氨酸和阴离子的运输
EAATs作为共转运蛋白工作,通过将一个K+离子从细胞外运输出,同时将谷氨酸神经递质/分子(也可以运输天冬氨酸)和三个Na+离子以及一个H+离子带入细胞内(Alleva et al., 2022),见图1(改编自Freidman et al., 2020)。这种运输依赖于钠离子的电化学梯度,并且由细胞膜上的EAATs的同源或异源三聚体促进(Kovermann et al., 2022)。
EAATs不仅是谷氨酸转运体,还是阴离子通道(Cl+),它们在谷氨酸运输周期内的转换响应中打开(Otis & Jahr, 1998)。
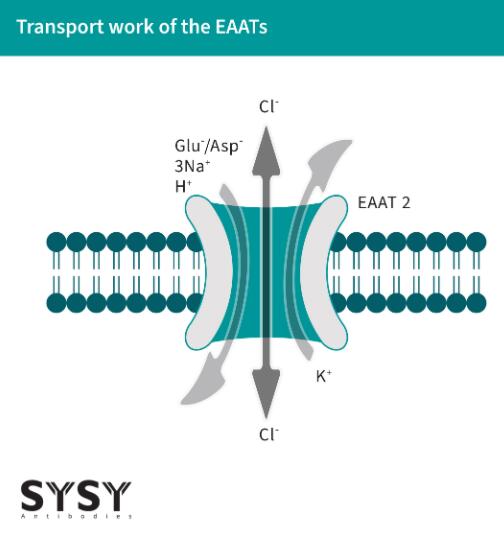
图1:EAAT对谷氨酸和阴离子的运输
最近发表的数据表明,EAAT5是EAAT家族中特定于视网膜的成员,它不仅作为谷氨酸的导入器,还作为谷氨酸门控的Cl-通道,特别是在视锥细胞中(Lukasiewcz et al., 2021)。
当谷氨酸通过EAATs被吸收进入胶质细胞时,它被转化为谷氨酰胺,随后被运输回突触前神经元,再转化为谷氨酸,并由VGLUTs的作用被吸收进突触小泡中。这个过程被称为谷氨酸-谷氨酰胺循环(Andersen & Schousboe, 2023),见图2。
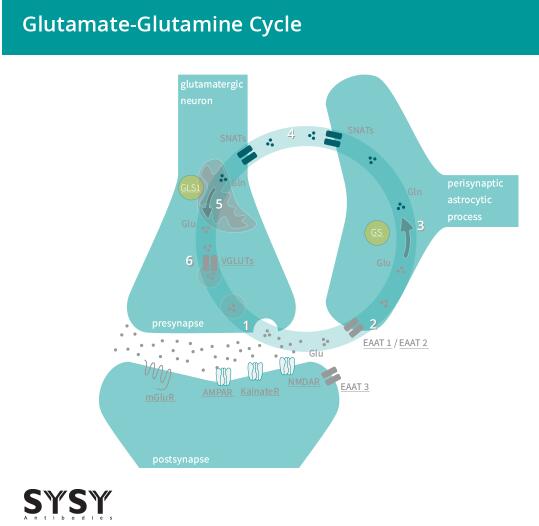
图2:谷氨酸能神经元与星形胶质细胞之间的谷氨酸-谷氨酰胺循环。
(1) 谷氨酸(Glu)被释放并与离子型和代谢型受体(AMPAR/GluA, KainateR/GluK, NMDAR/GluN, mGluRs)结合。(2) 谷氨酸主要由星形胶质细胞通过兴奋性氨基酸转运体EAAT 1/2吸收,部分由神经元通过EAAT3吸收。(3) 星形胶质细胞的谷氨酰胺合成酶将谷氨酸(Glu)转化为谷氨酰胺(Gln)。(4) 突触不活跃的谷氨酰胺从星形胶质细胞转移到神经元。(5) 谷氨酰胺(Gln)通过线粒体谷氨酰胺酶1(GLS1)被转化回谷氨酸(Glu)。(6) 谷氨酸通过囊泡谷氨酸转运体(VGLUTs)被转运进小泡,并准备好进行下一轮的传递。
EAAT的分布
EAAT家族目前由5个成员组成,分别是EAAT1到EAAT5,它们在谷氨酸摄取动力学、氯离子通透性和分布程度上各不相同(Todd & Harding, 2020),见表1。
表1:
protein | gene | molecular mass (mouse) | Cl-conduct. | tissue distribution |
EAAT1 | SLC1A3 | ~ 60 kDa | mod. | Astroglia (low level in lung, spleen, skeletal muscle and testis) |
EAAT2 | SLC1A2 | ~ 62 kDa | low | mainly astroglia; mediates >90% of CNS glutamate reuptake |
EAAT3 | SLC1A1 | ~57 kDa | mod. | all neurons – located on dendrites and axon terminals, epithelial cells of the kidney and the gastrointestinal tract (low level in lung, kidney, skeletal muscle and small intestine) |
EAAT4 | SLC1A6 | ~61 kDa | high | neurons (postsynaptic, dendritic spines) in cerebellum |
EAAT5 | SLC1A7 | ~60 kDa | high | CNS: predominantly retina |
EAAT1:
EAAT1,也称为GLAST-1,在整个中枢神经系统中表达,在小脑的星形胶质细胞和Bergmann胶质细胞中高度表达。在视网膜中,EAAT1在Müller细胞中表达。
稳健的EAAT表达,特别是EAAT1,是成人神经干细胞(NSC)表型的广泛使用的标志物(Rieskamp等人,2023)。
我们提供几种经KO验证的抗体用于检测EAAT1。
| EAAT1产品 | |||
| 货号 | 名称 | 应用 | 规格 |
| 250 103 | EAAT1,rabbit,polyclonal,affinity purified K.O. extracellulardomain | WB | 50 μg |
| 250 113 | EAAT1,rabbit,polyclonal,affinity purified K.O. cytoplasmic domain | WB IP ICC IHC | 50 μg |
| 250 114 | EAAT1,Guinea pig,polyclonal,antiserum cytoplasmic domain | WB ICC IHC IHC-P | 100μl |
| 250 116 | EAAT1,chicken,polyclonal,IgY fraction cytoplasmic domain | WB ICC IHC | 200 μl |
| 250-11P | EAAT1,control peptide cytoplasmic domain | 100 μg | |
| 250-1P | EAAT1,control peptide extracellulardomain | 100 μg | |
|
|
图3:用兔多克隆抗EAAT1(目录号250 113,稀释度1:5000;红色)对野生型(WT)和敲除型(KO)动物的小鼠小脑中的EAAT1进行间接免疫染色。图片提供:奥斯陆大学基础医学研究所解剖学系周云和Niels Christian Danbolt | 图4:PFA固定的小鼠小脑用豚鼠多克隆抗EAAT1(目录号250 114,稀释度1:500;红色)和兔抗细小白蛋白(目录号195 002,稀释度1:100;绿色)进行间接免疫染色。DAPI染色(蓝色)显示细胞核。 |
EAAT2:
EAAT2,也称为GLT-1,是大脑中EAATs中含量最丰富的。它主要位于星形胶质细胞分支,分别在小脑和海马体中高度表达(Yeung等人,2021)。最近,Dahlmanns等人在2023年综述了几种神经退行性疾病,如阿尔茨海默病、多发性硬化症和肌萎缩侧索硬化症(ALS),发现EAAT2减少。在此背景下,值得注意的是,γ分泌酶的活性亚基早老素1(PS1)直接与EAAT2相互作用,并影响转运蛋白的细胞表面定位(Perrin等人,2024)。
对于EAAT2的检测,我们可以提供优秀的、KO验证的、多克隆的兔和豚鼠抗体。此外,还有一种小鼠单克隆抗体,在WB、ICC、IHC和FFPE(IHC-P)应用中显示出优异的结果。
| EAAT2产品 | |||
| 货号 | 名称 | 应用 | 规格 |
| 250 203 | EAAT2,rabbit,polyclonal,affinity purified (K.O. extracellular domain | WB IHC IHC-P | 50 μg |
| 250 204 | EAAT2,Guineapig,polyclonal,antiserum (K.O. extracellular domain | WB ICC IHC IHC-P | 100 μl |
| 250 211 | EAAT2,mouse,monoclonal,purified IgG extracellular domain | WB ICC IHCIHC-P | 100 μg |
| 250-2P | EAAT2,control peptide extracellular domain | 100 μg | |
|
|
图5:杂合子(+/-)和敲除(-/-)小鼠新皮层中EAAT2的间接免疫染色(分类号250 203,稀释度1:2000;红色)。图片提供:奥斯陆大学基础医学研究所解剖学系周云和Niels Christian Danbolt | 图6:PFA固定的大鼠海马神经元用抗EAAT2(目录号250 204,稀释度1:500;红色)和小鼠抗MAP2(目录编号188 011,稀释度1:100;绿色)进行间接免疫染色。DAPI染色(蓝色)显示细胞核。 |
EAAT3:
EAAT3,也称为EAAC1或SLC1A1,是大脑中的“神经元”谷氨酸转运蛋白,主要位于轴突末端和大脑皮层、海马、纹状体和基底节的树突(Escobar等人,2019)。最新的研究结果假设EAAT3表达与强迫症(OCD)之间存在联系,Escobar等人于2019年对此进行了综述。中枢神经系统外的EAAT3可以在肺、小肠、骨骼肌、肾外髓质、髓质射线和皮质中发现(Todd&Hardingham,2020)。
我们的产品组合中提供2种优秀的多克隆兔抗体。
| EAAT3产品 | |||
| 货号 | 名称 | 应用 | 规格 |
| 250 303 | EAAT3,rabbit,polyclonal,affinity purified currently not available | ICC IHC | 50 μg |
| cytoplasmic domain | |||
| 250 313 | EAAT3,rabbit,polyclonal,affinity purified cytoplasmic domain | WB | 50 μg |
| 250-31P | EAAT3,control peptide cytoplasmic domain | 100 μg | |
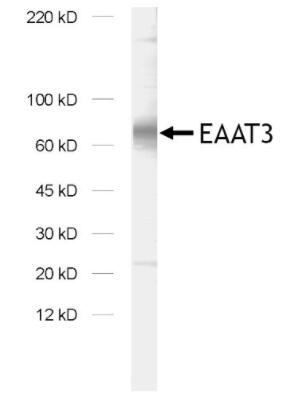
图7:用兔多克隆抗EAAT3(目录号250 313)对大鼠脑突触膜部分(LP1)中的EAAT3进行免疫印迹。
EAAT4:
EAAT4,也称为SLC1A6,是一种主要的神经元谷氨酸进口商。它主要位于小脑的浦肯野细胞上,在前脑和中脑的某些亚区有一些稀疏的表达(Massie等人,2008)。最近的数据显示,EAAT4的表达遵循类似于醛缩酶C(zebrin)表达的副矢状带模式,产生了EAAT4水平高低的分子多样性浦肯野细胞的微区(Malhotra等人,2021)。与EAAT1和EAAT2相比,EAAT4的谷氨酸转运能力相当低,因此一些研究人员推测EAAT4在生理上主要作为阴离子通道发挥作用(Suslova等人,2023)。
我们的产品组合中新增了2种针对EAAT4的优秀兔多克隆抗体。
|
|
图8:甲醛固定的小鼠小脑切片(矢状)兔抗EAAT4抗体(目录号250 413,稀释度1:500,红色)和豚鼠抗Calbindin抗体(目录编号214 318,稀释度1:100,绿色)的间接免疫染色。DAPI染色(蓝色)显示细胞核。 | 图9:甲醛固定的小鼠小脑切片(冠状)兔抗EAAT4抗体(目录号250 413,稀释度1:500,红色)和豚鼠抗Calbindin抗体(目录编号214 318,稀释度1:100,绿色)的间接免疫染色。DAPI染色(蓝色)显示细胞核。 |
EAAT5:
EAAT5蛋白,有时也称为AAAT,主要存在于脊椎动物视网膜中,在那里它(与EAAT2一起)将谷氨酸转运到视杆细胞、视锥细胞和视杆双极细胞中。EAAT5转运蛋白聚集在突触前杆和锥活性区的突触带下方,位置完美,可以捕获最近释放的谷氨酸。对EAAT5的抑制表明,该蛋白对视网膜中甘氨酸能无长突细胞(AII无长突细胞)的时间信号分辨很重要(Tang等人,2022)。在中枢神经系统外,EAAT5也在肝脏、肾脏、肠道、心脏、肺和肌肉中表达。我们提供了一种针对EAAT5的多克隆豚鼠KO验证抗体。
| EAAT5产品 | |||
| 货号 | 名称 | 应用 | 规格 |
| 250 504 | EAAT5, Guinea pig, polyclonal, antiserum | IHC IHC-P | 100 ?l |
|
|
图10:野生型(WT)和敲除型(KO)动物小鼠视网膜中EAAT5的间接免疫染色(分类号250 504,稀释度1:2000;红色)。根据(Gehlen等人,2021),用4%甲醛浸泡固定组织,用1%SDS进行抗原修复。图片提供:Christoph Aretzweiler von Schwartzenberg和Frank Müller,德国Forschungszentrum Jülich生物信息处理、分子和细胞生理学研究所(IBI-1) | 图11:用豚鼠抗EAAT5抗体(目录号250 504,稀释1:1000,DAB;棕色)对福尔马林固定石蜡包埋(FFPE)小鼠回肠切片进行间接免疫染色。苏木精染色(蓝色)显示细胞核。 |
产品:
| 货号 | 名称 | 应用 | 规格 |
| 250 103 | EAAT1,rabbit,polyclonal,affinity purified(K.0. extracellular domain | WB | 50 μg |
| 250 113 | EAAT1,rabbit,polyclonal,affinity purified(K.O.) cytoplasmic domain | WB IP ICC IHC | 50 μg |
| 250 114 | EAAT1,Guineapig,polyclonal,antiserum cytoplasmic domain | WB ICC IHCIHC-P | 100 μl |
| 250 116 | EAAT1,chicken,polyclonal,IgY fraction cytoplasmicdomain | WB ICC IHC | 200μl |
| 250-11P | EAAT1,control peptide cytoplasmicdomain | 100pg | |
| 250-1P | EAAT1,control peptide extracellular domain | 100 μg | |
| 250 203 | EAAT2,rabbit,polyclonal,affinity purified(K.O.) extracellulardomain | WB IHC IHC-P | 50 μg |
| 250 204 | EAAT2,Guinea pig,polyclonal,antiserum (K.0. extracellular domain | WB ICC IHC IHC-P | 100 μl |
| 250 211 | EAAT2,mouse,monoclonal,purified IgG extracellular domain | WB ICC IHCIHC-P | 100pg |
| 250-2P | EAAT2,control peptide extracellular domain | 100 μg | |
| 250 303 | EAAT3,rabbit,polyclonal,affinity purified currently not available cytoplasmic domain | 50 μg | |
| CC IHC | |||
| 250313 | EAAT3,rabbit,polyclonal,affinity purified cytoplasmic domain | WB | 50 pg |
| 250-31P | EAAT3,control peptide cytoplasmicdomain | 100 μg | |
| 250 403 | EAAT4,rabbit,polyclonal,affinity purified | WB | 50 μg |
| 250 413 | EAAT4, rabbit, polyclonal, affinity purified | WB ICC IHC IHC-P | 50 ?g |
| 250 504 | EAAT5, Guinea pig, polyclonal, antiserum | IHC IHC-P | 100 ?l |
文献参考:
Alleva et al., 2022: Molecular Basis of Coupled Transport and Anion Conduction in Excitatory Amino Acid Transporters. PMID: 33587237
Andersen & Schousboe, 2023: Glial Glutamine Homeostasis in Health and Disease. PMID: 36322369
Dahlmanns et al., 2023: Glial Glutamate Transporter-Mediated Plasticity: System xc-/xCT/SLC7A11 and EAAT1/2 in Brain Diseases. PMID: 37005761
Escobar et al., 2019: The Neuronal Glutamate Transporter EAAT3 in Obsessive-Compulsive Disorder. PMID: 31803055
Freidman et al., 2020: Amino Acid Transporters and Exchangers from the SLC1A Family: Structure, Mechanism and Roles in Physiology and Cancer. PMID: 31981058
Kovermann et al., 2022: Cellular Physiology and Pathophysiology of EAAT Anion Channels. PMID: 35087380
Lukasiewcz et al., 2021: EAAT5 Glutamate Transporter-Mediated Inhibition in the Vertebrate Retina. PMID: 34025361
Malhotra et al., 2021: Climbing Fiber-Mediated Spillover Transmission to Interneurons Is Regulated by EAAT4. PMID: 34400517
Massie et al., 2008: High-affinity Na+/K+-dependent glutamate transporter EAAT4 is expressed throughout the rat fore- and midbrain. PMID: 18770868
Otis & Jahr, 1998: Anion currents and predicted glutamate flux through a neuronal glutamate transporter. PMID: 9736633
Perrin et al., 2024: Identification of PS1/gamma-secretase and glutamate transporter GLT-1 interaction site. PMID: 38499151
Rieskamp et al., 2023: Excitatory amino acid transporter 1 supports adult hippocampal neural stem cell self-renewal. PMID: 37534178
Suslova et al., 2023: Apo state pore opening as functional basis of increased EAAT anion channel activity in episodic ataxia 6. PMID: 37538371
Tang et al., 2022: Glutamate Transporters EAAT2 and EAAT5 Differentially Shape Synaptic Transmission from Rod Bipolar Cell Terminals. PMID: 35523583
Todd & Hardingham, 2020: The Regulation of Astrocytic Glutamate Transporters in Health and Neurodegenerative Diseases. PMID: 33348528
Yeung et al., 2021: EAAT2 Expression in the Hippocampus, Subiculum, Entorhinal Cortex and Superior Temporal Gyrus in Alzheimer’s Disease. PMID: 34588956

微信扫码在线客服