仅切割未被取代的Gal-β(1-3)GalNAcα二糖,这些二糖连接在糖蛋白或糖肽的丝氨酸或苏氨酸残基上。必须先用适当的外切糖苷酶去除唾液酸、半乳糖、岩藻糖或N-乙酰氨基葡萄糖等取代基,然后才能用O-糖苷酶处理。至少,通常需要使用神经氨酸酶,例如编号E-S001的神经氨酸酶Au(Alpha-2-3,6,8,9),来去除唾液酸。
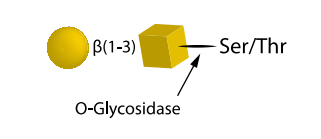
艾美捷QA-Bio-O-糖苷酶:
产品编号:E-G001
推荐与E-G001配套使用的试剂包括:
1瓶:5倍反应缓冲液,250 mM 磷酸钠,pH 5.0
活性 ≥ 1.25 U/ml
比活性 ≥ 12 U/mg
比活性定义:O-糖苷酶的一个单位定义为在37°C、pH 5.0条件下,1分钟内产生1微摩尔对硝基苯酚(pNP)所需的酶量,该反应来自对硝基苯基2-乙酰氨基-2-脱氧-3-O-(β-D-半乳糖吡喃糖基)-α-D-半乳糖吡喃苷。
储存:在4°C下储存酶,不要冷冻。
配方:酶作为无菌过滤溶液提供,在50 mM 磷酸钠(pH 7.5)中。
分子量:约180,000道尔顿
pH 最佳值:5,活性范围5-7。
纯度:
O-糖苷酶的污染蛋白酶测试如下:将10?g变性BSA与2?l酶在37°C下孵育24小时。经处理的BSA的SDS-PAGE分析显示没有降解的迹象。生产宿主菌株已经过广泛测试,不产生任何可检测的糖苷酶。
文献参考:
Bhavanandan, V.P. , J. Umemoto and E.A.Davidson. Characterization of an endo-alpha-Nacetylgalactosaminidase from Diplococcus pneumoniae.Biochem Biophys 70:738-745 (1976).
Fan, J. Q., K. Yamamoto, H. Kumagai and T. Tochikura.Induction and efficient purification of endo-alpha-Nacetyl-D-galactosaminidase from Alcaligenes sp. AgricBiol Chem 54:233-234 (1990).
Glasgow, L R., J. C. Paulson and R. L. Hill. Systematicpurification of five glycosidases from Streptococcuspneumoniae. J Biol Chem 252:8615-8623 (1977).
Iwase, H. and K. Hotta. Release of O-linked glycoproteinglycans by endo-alpha-N-acetyl-D-galactosaminidase.Methods Mol Biol 14:151-159 (1993).
Unemoto, J., V. P. Bhavanandan and E. A. Davidson.Purification and properties of an endo-alpha-N-acetylD-galactosaminidase from Diplococcus pneumoniae. JBiol Chem 252:8609-8614 (1977).
本产品仅用于体外研究。

微信扫码在线客服