补体TCC是一种酶免疫测定法,用于半定量测定人EDTA血浆中的可溶性末端补体复合物(sTCC,也称为TCC或sC5b-9)。该产品仅限于专业使用。结果不得用于临床诊断或患者管理。仅限研究使用。
总结和解释:
在所有需要确定补体功能的情况下,TCC水平可以作为对三条补体途径功能评估的补充,提供非常有价值的信息。它反映了给定样本中补体的历史性体内活性。
补体系统在慢性、自身免疫和感染性疾病中发挥着至关重要的作用。补体激活有三条途径,即经典途径、替代途径和凝集素途径。可溶性末端补体复合物是末端途径的产物,可以是所有三条补体激活途径的结果。由于TCC反映了最终末端途径的激活,而不考虑最初涉及的途径,因此它是评估补体激活的特别好的候选指标(Harboe 2011)。
众所周知,补体系统在各种病理条件下组织层面炎症过程的发展和放大中起着关键作用。例如在溶血性尿毒症综合征(HUS)(Noris 2012)、系统性红斑狼疮(SLE)(Porcel 1995, Mollnes 1999)和类风湿性关节炎(RA)(Struglics 2016)中可以检测到TCC水平的增加。补体系统也可以被人工表面激活,例如在血液透析或心肺转流期间,导致TCC水平增加(Deppish 1990, Ovrum 1996)。TCC也非常适合研究医疗器械中生物材料激活补体的情况(Stang 2014)。TCC可以像补体的其他激活产物一样,在使用新表位特异性单克隆抗体的测定中被测量。新表位隐藏在原始补体成分中,并在补体激活后暴露(Mollnes 1985, Mollnes 1993)。
艾美捷末端补体复合物(TCC)检测试剂盒(Complement TCC)(#COMPLTCCRUO)的测定原理:
该测定是一种比色法夹心ELISA。样本在测定稀释液中稀释,100?L稀释样本转移到微孔板孔中,并在室温下孵育60分钟。在这次第一次孵育期间,样本中的TCC被预涂在微孔板孔表面的抗TCC单克隆抗体捕获。洗涤以去除未结合的物质后,加入第二种辣根过氧化物酶(HRP)标记的单克隆抗体以检测结合到孔中的TCC。孵育30分钟后再次洗涤孔,并添加底物进行孵育。30分钟后停止颜色发展,并在分光光度计中测量颜色。颜色的深浅与结合到孔中的TCC量成正比。TCC的量通过与校准样本的颜色发展进行比较来确定。
操作程序:
1. 将试剂(微孔板、校准器、对照、稀释液、洗涤液、结合物、底物和终止液)平衡至室温(20°C - 25°C)。
2. 将洗涤液稀释30倍(例如,30 ml浓缩洗涤液 + 870 ml纯水)。
3. 将EDTA血浆样本在室温下解冻。
4. 将解冻的血浆样本保存在冰上。
5. 用稀释液1/10稀释样本(例如,30 ?l血浆 + 270 ?l稀释液)。建议使用预稀释板。
6. 将100?L稀释样本、校准器和对照转移到微孔板孔中,每孔两份,并在室温下孵育60分钟。
注意:建议快速将样本、校准器和对照转移到板上,以避免信号漂移。
7. 用稀释洗涤液300 ?l洗涤3次,通过填充和清空孔来完成。最后一次洗涤后,通过在吸水纸上轻敲条带来清空孔。
8. 向孔中加入100 ?l结合物。在室温下孵育30分钟。
用稀释洗涤液300 ?l洗涤3次,通过填充和清空孔来完成。最后一次洗涤后,通过在吸水纸上轻敲条带来清空孔。
9. 向孔中加入100 ?l底物。在室温下孵育30分钟。
10. 向孔中加入100 ?l终止液。
11. 在酶标仪上读取450 nm处的吸光度。以620 nm作为参考波长读取。
结果计算:
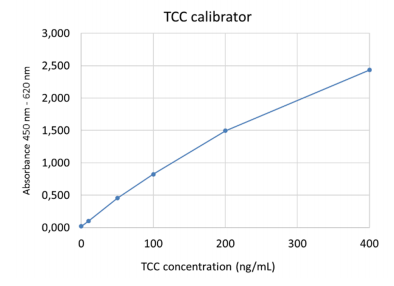
从450nm波长中减去参考波长,并计算所有样本的平均OD值。通过绘制校准器的OD值与浓度构建校准曲线。六种校准器的值为0 ng/mL、10 ng/mL、50 ng/mL、100 ng/mL、200 ng/mL和400 ng/mL。根据校准曲线读取未知样本的浓度。
注意:本IFU中的所有性能数据都是使用4参数曲线拟合计算的。用户可以选择不同的曲线拟合。建议每个实验室使用选定的曲线拟合建立参考范围。
注意:要计算样本中TCC的浓度,必须根据上述协议进行稀释补偿,即10倍。如果样本结果超出校准曲线,建议进行更高倍数的稀释,并在计算样本中的浓度时考虑这一点。
请注意:上图显示的是半定量标准曲线的示例,不应用于实际样本的解释。
校准器曲线示例:
末端补体复合物(TCC)检测试剂盒(Complement TCC)文献参考:
Bergseth et al. Molecular Immunology 56 (2013) 232–239. An international serum standard for
application in assays to detect human complement activation products
Deppisch et al, Kidney Int. 1990 Feb;37(2):696-706. Fluid phase generation of terminal
complement complex as a novel index of bioincompatibility
Harboe et al, Adv Drug Deliv Rev. 2011 Sep 16;63(12):976-87. Advances in assay of
complement function and activation.

微信扫码在线客服