研究目的:
Wieslab 补体系统经典途径是一种酶免疫测定法,用于定性或半定量测定人血清中功能性经典补体途径,其结果不得用于临床诊断或患者管理。
概述和解释
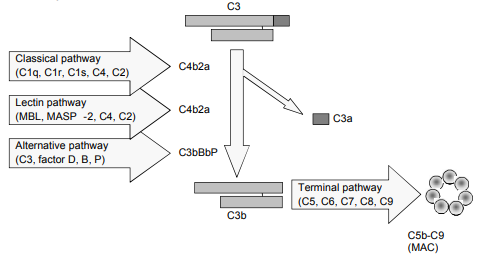
补体系统在慢性、自身免疫和感染性疾病中发挥着重要作用。补体激活有三个途径(图1),即经典途径、替代途径和凝集素途径。
补体活性受损会导致人类易患重复性暴发性或严重感染,并可能促进自身免疫疾病的发展。补体的不适当激活会导致慢性炎症和组织损伤。
体外补体序列的激活导致补体成分的消耗,这反过来导致它们浓度的降低。因此,补体蛋白或补体活性的测定用于指示补体系统是否已被免疫和/或病理机制激活。当怀疑补体激活性疾病或可能存在遗传性缺陷时,功能性和免疫化学补体测量都用于评估个体。通过功能性测定(如Wieslab 补体试剂盒)评估的补体活性水平考虑了成分的合成、降解和消耗速率,并提供了途径完整性的度量,与免疫化学方法相对,后者专门测量各种补体成分的浓度。
艾美捷WIESLAB补体系统经典途径(WIESLAB Complement System Classical Pathway)(#COMPLCP310)的测定原理:
Wieslab 补体经典途径测定结合了补体激活的溶血测定原理和使用特定于补体激活产生的新抗原的标记抗体。产生的新抗原量与补体途径的功能活性成正比。
在补体CP试剂盒中,微孔板条的孔被经典途径的特定激活剂包被。这与样本稀释缓冲液组成和血清稀释水平相结合,确保只有经典途径被激活。
在孔中孵育稀释的血清期间,补体通过特定包被被激活。然后洗涤孔,并使用特定的碱性磷酸酶标记抗体检测在MAC(膜攻击复合物)形成期间形成的C5b-9新抗原上的C5b-9复合物。
在进一步洗涤步骤后,通过与碱性磷酸酶底物溶液孵育获得特定抗体的检测。补体激活量与颜色强度相关,并以吸光度(光密度(OD))来衡量。
样本收集:
血液样本应使用无菌静脉穿刺技术收集,并使用标准程序获得血清。建议至少收集5毫升全血。让血液在血清管中凝固60-65分钟,室温(20-25°C)。离心血液样本,并将无细胞血清转移到干净的管中。血清必须正确处理以防止体外补体激活。血清应密封在紧紧封闭的管中冷冻在-70°C或更低的温度下,以便于长期储存或在干冰上运输。样本不应多次冷冻和解冻。
不要使用黄疸、乳糜和溶血的血清。不能使用热灭活血清。
不能使用血浆。CLSI提供了储存血液样本的建议(血液样本处理和处理程序的批准标准-程序,H18A,1990年)。
试剂盒组件和试剂储存:
一个框架,带有无色分离孔(12x8),涂有人类IgM,密封在带有干燥剂的铝箔包装中。
2 x 35毫升CP稀释液(Dil CP),标为蓝色。
13毫升含有碱性磷酸酶标记的C5b-9抗体的结合物(蓝色)。
13毫升即用型底物溶液。
30毫升30倍浓缩的洗涤溶液。
0.2毫升阴性对照(NC),含有人血清(应按个体血清样本稀释)。
冻干阳性对照(PC),含有冻干人血清,需在0.2毫升蒸馏水中重组,见下文“阳性对照的重组”。
冻干活性对照(AC),用于半定量应用,含有冻干人血清(与PC来源不同),见“半定量应用程序下的活性对照重组”。
阳性对照和活性对照应到达后储存在-20°C。
请注意:AC的重组体积在分析证书(CoA)(XXX微升)和AC标签上标明。
试剂盒中的所有试剂都已准备好使用,除了洗涤溶液和对照品。试剂应储存在2-8°C,除了阳性对照和活性对照。重组的阳性对照和活性对照应储存在-70°C,并且只能解冻一次。
所需但未提供的物料或设备:
带有405纳米滤光片的微孔板读取器。
带有一次性吸头的精密移液器。
用于条带的清洗器、吸水纸、管子和一个计时器。
程序 定性应用:
仅取出所需数量的孔,小心重新密封铝箔包装。在分析前让所有溶液平衡至室温(20-25°C)。不要在不同批次的试剂之间混合。
洗涤溶液的准备
如果浓缩洗涤溶液瓶中观察到盐晶体,将瓶子置于37°C水浴中直到晶体溶解,然后再稀释洗涤溶液。
将30毫升30倍浓缩洗涤溶液稀释在870毫升蒸馏水中。当储存在2-8°C时,稀释后的洗涤溶液稳定直到试剂盒的有效期。
预期结果:
当发现补体成分或补体功能水平降低时,临床医生会考虑缺陷或正在进行的免疫过程,导致成分分解增加和补体水平降低。
对于定性测定,正常分布已确定为阳性对照的69-129%,见表1。在此范围内的结果表明经典途径的功能正常。建议每个实验室确认或建立自己服务人群的参考范围。
低于69-129%范围的值表明要么由于经典补体途径容量的消耗导致增加的激活,要么基因决定的低活性。
低于5%的值强烈表明由于过度激活或经典途径的遗传性缺陷导致的完全缺乏。为了确定导致活性降低的补体因子,需要进一步分析补体蛋白。
阴性结果,即怀疑缺乏,应始终通过测试新的、仔细处理的样本来验证,以确保没有发生体外补体激活。
补体水平的增加通常是急性期反应的非特异性表现。
Wieslab 补体系统经典途径可以帮助检测与经典途径相关的补体缺陷,如下表所示:使用Wieslab 补体系统筛选,可以更完整和深入地功能性评估所有三个补体途径。
WIESLAB补体系统经典途径文献参考:
Walport M. Complement (First of two parts). N Engl J Med 2001; 344:1058-66.
Walport M. Complement (Second of two parts). N Engl J Med 2001; 344:1140-44.
Roos A et al. Functional characterization of the lectin pathway of complement in human serum.
Mol Immunol 2003; 39:655-68.
Fredriksson GN et al. New procedure for detection of complement deficiency by
ELISA. Analysis of activation pathways and circumvention of rheumatoid factor influence.
J Immunol Meth 1993; 166:263-70.
Seelen MA et al. Functional analysis of the classical, alternative and MBL pathways of the
complement system: standardization and validation of a simple ELISA. J Immunol Meth 2005;
296:187-98.
Salvador-Morales C, Sim RB. Handbook of Immunological Properties of Engineered
Nanomaterials. 2013, 1st Ed, World Scientific Publishing (ISBN: 978-4390-25-5).
Tudoran R & Kirschfink M. Modern Complement analysis: indications, methods and outlook.
LaboratoriumsMedizin 2012; 36(3):--.
Botto M et al. Complement in human disease: Lessons from complement deficiencies. Mol
Immunol 2009; 46:2774-83.
Mollnes TE et al. Complement analysis in the 21st century. Mol Immunol 2007; 44:3838-49.
Nilsson B, Nilsson Ekdahl K. Complement Diagnostics: Concepts, Indications, and Practical
Guidelines. Clin Develop Immunol; 2012, Art ID 962702

微信扫码在线客服