Wieslab补体系统替代途径试剂盒(WIESLAB Complement System Alternative Pathway)是一种酶免疫测定法,用于定性测定人血清中功能性替代补体途径。仅供体外诊断使用。
概述和解释:
补体系统在慢性、自身免疫和感染性疾病中发挥着重要作用。补体激活有三个途径(图1),即经典途径、替代途径和最近发现的MBL途径。
补体活性受损会导致人类易患重复性暴发性或严重感染,并可能促进自身免疫疾病的发展。补体的不适当激活会导致慢性炎症和组织损伤。
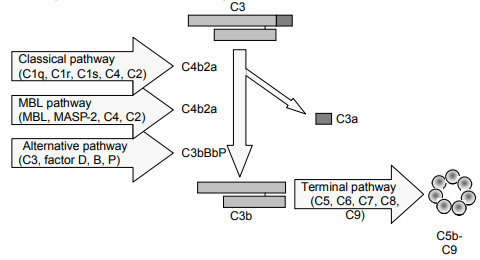
艾美捷Wieslab补体系统替代途径试剂盒(WIESLAB Complement System Alternative Pathway)(#COMPLAP330)的测定原理:
Wieslab 补体测定结合了补体激活的溶血测定原理和使用特定于补体激活产生的新抗原的标记抗体。产生的新抗原量与补体途径的功能活性成正比。
在补体系统AP试剂盒中,微孔板条的孔被特定的替代途径激活剂包被。患者血清在含有特定阻断剂的稀释液中稀释,以确保只有替代途径被激活。在孔中孵育稀释的患者血清期间,补体通过特定包被被激活。
然后洗涤孔,并使用特定的碱性磷酸酶标记抗体检测在MAC形成期间表达的新抗原的C5b-9。
在进一步洗涤步骤后,通过与碱性磷酸酶底物溶液孵育获得特定抗体的检测。补体激活量与颜色强度相关,并以吸光度(光密度(OD))来衡量。
试剂盒组件和试剂储存:
一个框架,带有无色分离孔(12x8),密封在带有干燥剂的铝箔包装中。孔被LPS包被。
35毫升AP稀释液(Dil AP),标为红色。
13毫升含有碱性磷酸酶标记的C5b-9抗体的结合物(蓝色)。
13毫升即用型底物溶液。
30毫升30倍浓缩的洗涤溶液。
0.2毫升阴性对照(NC),含有人血清。(应按患者血清样本稀释)。
0.2毫升阳性对照(PC),含有冻干人血清,见下文“阳性对照的重组”。
试剂盒中的所有试剂都已准备好使用,除了洗涤溶液和对照品。试剂应储存在2-8°C,除了阳性对照。阳性对照必须储存在-20°C。
所需但未提供的物料或设备:
带有405纳米滤光片的微孔板读取器。
带有一次性吸头的精密移液器。
用于条带的清洗器、吸水纸、管子和一个计时器。
操作程序:
仅取出所需数量的孔,小心重新密封铝箔包装。在分析前让所有溶液平衡至室温(20-25°C)。
洗涤溶液的准备
如果浓缩洗涤溶液瓶中观察到盐晶体,将瓶子置于37°C水浴中直到晶体溶解,然后再稀释洗涤溶液。将30毫升30倍浓缩洗涤溶液稀释在870毫升蒸馏水中。当储存在2-8°C时,稀释后的洗涤溶液稳定直到试剂盒的有效期。
阳性对照的重组:
轻轻敲击所有冻干物料至瓶底并取下盖子。立即向冻干物料中加入200微升蒸馏水。重新盖上盖子。让瓶子在冰上放置5分钟,然后轻轻摇晃或偶尔涡旋直到完全溶解。按患者血清样本的方式稀释重组对照品。重组对照品如果保持在2-8°C或冰上,可在使用前储存长达4小时。它可以在-70°C下冷冻并解冻一次。
血清:
通过在37°C水浴中短暂放置并轻轻混合,部分解冻冷冻血清。部分解冻后,立即将管子放入冰浴中,并在冰上放置直到完全解冻。在涡旋混合器上短暂混合。
血清稀释:
用AP稀释液(红色标签)按1/18的比例稀释血清(340微升稀释液+20微升血清)。稀释后的血清在分析前可以放置在室温下最多60分钟。
样品孵育:
根据图示,每个途径按重复孔加入100微升的空白(Dil AP)、阳性对照(PC)、阴性对照(NC)和稀释的患者血清(P)。在+37?C下孵育60-70分钟。
预期结果:
体外补体序列的激活导致补体成分的消耗,这反过来导致它们浓度的降低。因此,补体蛋白或补体活性的测定用于指示补体系统是否已被免疫和/或病理机制激活。当怀疑补体激活性疾病或可能存在遗传性缺陷时,使用功能性和免疫化学补体测量来评估患者。通过功能性测定(如Wieslab 补体试剂盒)评估的补体活性水平考虑了成分的合成、降解和消耗速率,并提供了途径完整性的度量,与免疫化学方法相对,后者专门测量各种补体成分的浓度。当发现补体成分或补体功能水平降低时,临床医生会考虑缺陷或正在进行的免疫过程,导致成分分解增加和补体水平降低。补体水平的增加通常是急性期反应的非特异性表现。
Wieslab 补体系统AP可以帮助检测与替代途径相关的补体缺陷,如下表所示:使用Wieslab 补体系统筛选,可以更完整和深入地功能性评估所有三个补体途径。
WIESLAB补体系统替代途径文献参考:
Walport M, Complement (First of two parts) N Engl J Med 2001, 344, 1058-1066.
Walport M, Complement (Second of two parts) N Engl J Med 2001, 344, 1140-1144.
Roos A, Bouwman L, Munoz J et al., Functional characterization of the lectin pathway of
complement in human serum. Mol Immunol 2003, 39, 655-668.
Nordin Frediksson G, Truedsson L, Sj?holm A. New procedure for detection of complement
deficiency by ELISA. J Imm Meth 1993, 166, 263-270.
M.A. Seelen et al, Functional analysis of the classical, alternative and MBL pathways of the
complement system: standardization and validation of a simple ELISA. J Imm Meth 2005,
296,187-198

微信扫码在线客服