对于许多免疫组织化学(IHC)应用,传统的酶扩增程序足以实现足够的抗原检测。然而,有几个因素限制了这些程序的敏感性和实用性。酪胺信号扩增(TSA)已被证明是一种特别通用和强大的酶扩增技术,具有提高的检测灵敏度。TSA基于HRP在低浓度过氧化氢存在下将标记的含酪胺底物转化为氧化的高反应性自由基的能力,该自由基可以共价结合HRP处或附近的酪氨酸残基。为了实现最大的IHC检测,酪胺用荧光团预标记。每个过氧化物酶标记的多个酪胺底物的周转所赋予的信号放大转化为对低丰度靶标的超灵敏检测以及使用少量抗体和杂交探针。在免疫组织化学应用中,TSA方法产生的灵敏度增强允许增加一次抗体稀释液以减少非特异性背景信号,并可以克服由次优固定程序或低水平靶表达引起的弱免疫标记。Cy3-酪胺含有明亮的Cy3,可以用标准的Cy3过滤器组很容易地检测到。
货号:AAT-11065
单位尺寸:1毫克
分子量:863.96
H-phrase:H303, H313, H333
仅限研究使用(RUO)
R-phrase:R20, R21, R22
储存:冷冻(< -15°C);尽量减少光照
激发:Cy3, TRITC滤光片组
发射:Cy3, TRITC滤光片组
推荐板: 黑色壁,透明底部
母液的制备:
除非另有说明,所有未使用的母液应在制备后分装成单次使用的小份,并储存在-20°C。避免反复冻融。
酪胺母液(1000X):加入适量的DMSO以制备1-5 mM的酪胺母液。
注意:制作单次使用的小份,并在2-8°C下避光储存未使用的1000X母液。避免反复冻融。
工作溶液的制备:
酪胺工作溶液(1X)
在含有0.003% H2O2的您选择的缓冲液中加入1 ?L的酪胺母液。
注意:为了最佳性能,请使用pH=7.4的Tris缓冲液。
注意:酪胺工作溶液应立即使用,并在当天新鲜制备。避免直接暴露于光线。
二抗-HRP工作溶液
根据制造商的建议,制备适当浓度的二抗-HRP工作溶液。
样品实验协议:
此协议适用于细胞和组织的染色。
细胞固定和渗透
用3.7%甲醛或多聚甲醛在PBS中室温固定细胞或组织20分钟。
用PBS冲洗细胞或组织两次。
用0.1% Triton X-100溶液在室温下渗透细胞1-5分钟。
用PBS冲洗细胞或组织两次。
组织固定、脱蜡和再水化
根据标准IHC协议进行组织的脱蜡和脱水。
过氧化物酶标记:
可选:通过在过氧化物酶封闭溶液(如3%过氧化氢)中孵育细胞或组织样本10分钟来抑制内源性过氧化物酶活性。用PBS在室温下冲洗两次。
可选:如果使用HRP共轭的链霉亲和素,建议用生物素封闭缓冲液阻断内源性生物素。
用首选的封闭溶液(如含1% BSA的PBS)在4°C下封闭30分钟。
移除封闭溶液,并加入推荐稀释液中稀释的一抗,在室温下孵育60分钟或在4°C下过夜。
用PBS冲洗三次,每次5分钟。
向每个样本施加100 ?L的二抗-HRP工作溶液,并在室温下孵育60分钟。
注意:孵育时间和浓度可根据信号强度进行调整。
用PBS冲洗三次,每次5分钟。
酪胺标记:
准备并施加100 ?L的酪胺工作溶液到每个样本,并在室温下孵育5-10分钟。
注意:如果观察到非特异性信号,可以缩短与酪胺的孵育时间。您应该使用不同孵育时间点的阳性和阴性对照样本来优化孵育期。或者您可以在工作溶液中使用更低浓度的酪胺。
用PBS冲洗三次。
对比染色和荧光成像
根据需要对细胞或组织样本进行对比染色。AAT提供了一系列核对比染色试剂,如表1所列。请遵循试剂附带的说明。
使用具有防褪色特性的封片介质安装盖玻片。
注意:为确保最佳结果,建议使用ReadiUse?显微镜封片溶液(目录号20009)或FluoroQuest? TSA/PSA防褪色封片介质*优化用于酪胺和丙烯酰胺成像*(目录号44890)代替Vectashield?封片介质。在某些情况下,Vectashield?封片介质可能不适用于某些TSA/PSA缀合物。
使用适当的滤光片组来观察酪胺标记的信号。
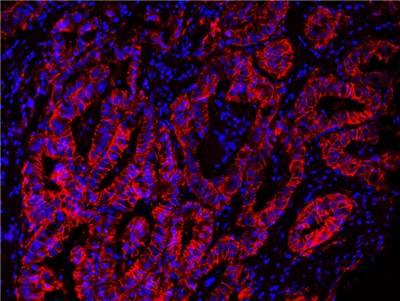
图:石蜡包埋的人肺癌的免疫荧光图像,用EpCAM兔单克隆抗体标记,然后用HRP标记的山羊抗兔IgG(H+L)标记(Cat#16793)。该信号是用AAT的Cy3-酪胺(Cat#11065,红色)产生的。细胞也用DAPI(蓝色)复染。
Cy3酪胺(Cy3 tyramite)文献参考:
Enhanced detection of Porcine reproductive and respiratory syndrome virus in fixed tissues by in situ hybridization following tyramide signal amplification
Authors: Trang NT, Hirai T, Ngan PH, Lan NT, Fuke N, Toyama K, Yamamoto T, Yamaguchi R.
Journal: J Vet Diagn Invest (2015): 326
Tyramide Signal Amplification for Immunofluorescent Enhancement
Authors: Faget L, Hnasko TS.
Journal: Methods Mol Biol (2015): 161
Rapid and sensitive detection of Escherichia coli O157:H7 in milk and ground beef using magnetic bead-based immunoassay coupled with tyramide signal amplification
Authors: Aydin M, Herzig GP, Jeong KC, Dunigan S, Shah P, Ahn S.
Journal: J Food Prot (2014): 100
Multiplexed immunohistochemistry, imaging, and quantitation: a review, with an assessment of Tyramide signal amplification, multispectral imaging and multiplex analysis
Authors: Stack EC, Wang C, Roman KA, Hoyt CC.
Journal: Methods (2014): 46
KSHV cell attachment sites revealed by ultra sensitive tyramide signal amplification (TSA) localize to membrane microdomains that are up-regulated on mitotic cells
Authors: Garrigues HJ, Rubinchikova YE, Rose TM.
Journal: Virology (2014): 75

微信扫码在线客服