肠促胰素的历史
1902年,William Bayliss和Ernest Starling发现了一种他们称之为“促胰液素”(secretin)的肽类激素,这种激素由肠道产生并刺激胰腺液的分泌。他们后来创造了“激素”(hormones)一词来描述这一类肽。三十年后,Jean La Barre博士使用“肠促胰素”(incretin)一词来指代刺激胰腺激素分泌的肠道激素。20世纪70年代,研究人员确定了葡萄糖依赖性促胰岛素多肽(GIP),这是一种由肠道产生的肽类,可抑制胃酸分泌并在高血糖期间释放胰岛素。随后的十年中,发现了胰高血糖素样肽-1(GLP-1),这是另一种由肠道产生的肽类激素,能刺激胰岛素的释放。尽管原始定义中的肠促胰素理论上包括如胃泌素和PYY等肠道激素,但大多数肠促胰素研究都集中在GIP和GLP-1上,它们是刺激胰腺胰岛素生产和分泌的主要肠道激素。
ALPCO中国区总代理,艾美捷科技,提供这些仅供研究使用的检测试剂盒,以支持2型糖尿病和肥胖症等代谢性疾病的研究。本文探讨了这些试剂背后的科学。

GIP和GLP-1在糖尿病和肥胖中的角色
肠促胰素效应
GIP和GLP-1主要在肠道中产生,并在摄入营养物质后刺激胰腺分泌胰岛素。肠促胰素激素的分泌取决于营养物质的吸收率(如葡萄糖、氨基酸和脂肪酸),并在进食后几分钟内发生。肠促胰素效应指的是口服相比静脉注射葡萄糖后胰岛素分泌的增强。虽然胰腺中的胰岛细胞会增加对葡萄糖代谢物的胰岛素输出,但GIP和GLP-1可能负责高达70%的口服葡萄糖引起的胰岛素响应,口服后的胰岛素水平是静脉注射后的两到三倍。
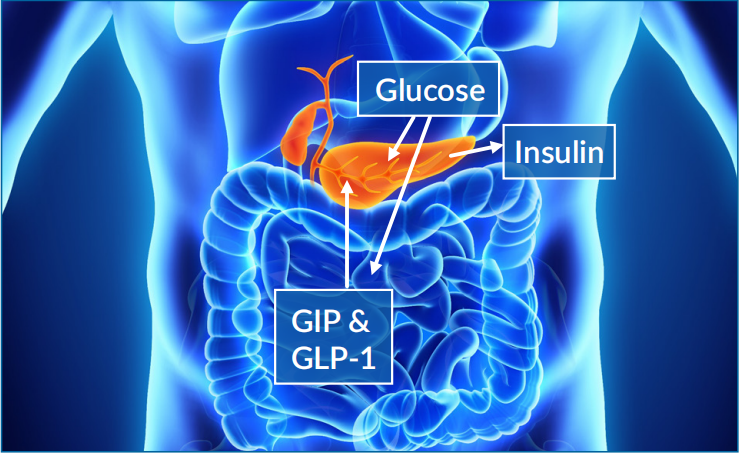
图1:肠促胰岛素刺激胰腺分泌更多的胰岛素。
葡萄糖依赖性促胰岛素多肽(GIP)
GIP是一种由小肠中的肠内分泌K细胞产生的42个氨基酸的肽,它对葡萄糖、蛋白质或脂肪的摄入有反应。GIP在海马体中有表达,其受体在大脑的多个区域也有表达。GIP受体存在于α和β胰岛细胞上。与GLP-1类似,GIP以剂量依赖的方式刺激β细胞分泌胰岛素,但GIP还刺激α细胞在丙氨酸存在时释放胰高血糖素。GIP在α细胞中的活性有助于通过α到β胰岛细胞的通信来促进胰岛素分泌。α细胞中GIP受体活性的丧失,从而阻止胰高血糖素的分泌,是葡萄糖不耐受的一个因素。局部产生的肠促胰素可能在胰岛对胰岛素抵抗的响应中发挥重要作用。尽管水平很高,但在2型糖尿病中,GIP几乎完全失活。活性GIP(1-42)被酶DPP-IV裂解成GIP(3-42),后者不显示胰岛素刺激活性。
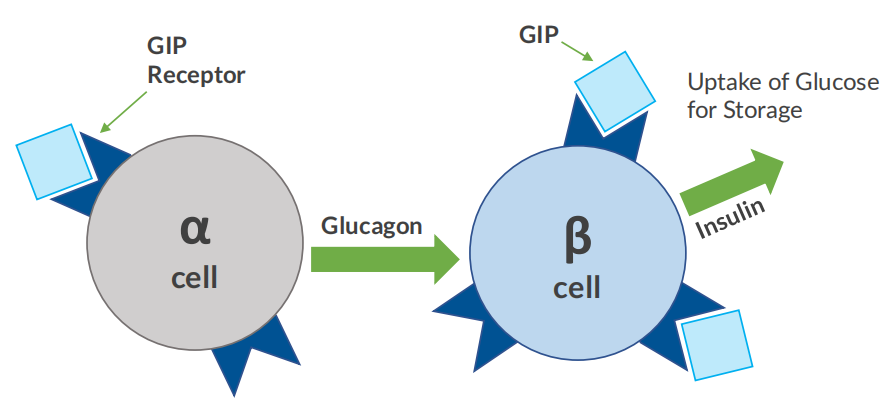
图2:α和β细胞上GIP与GIP受体的结合
胰高血糖素样肽-1(GLP-1)
GLP-1是一种由小肠和大肠中的肠内分泌L细胞产生的30个氨基酸的肽。胰岛素、生长抑素和神经肽galanin可以抑制L细胞分泌GLP-1。GLP-1也由脑干中的神经元和胰腺中的α细胞产生。GLP-1受体广泛存在于大脑中,并被神经元释放的GLP-1激活。与GIP不同,GLP-1抑制胰高血糖素的分泌。尽管一些研究在α细胞亚群上发现了GLP-1受体,但GLP-1主要通过与δ细胞上的受体结合并产生抑制胰高血糖素分泌的生长抑素来抑制胰高血糖素分泌。人体中循环的大部分GLP-1是活性GLP-1(7-36)形式。
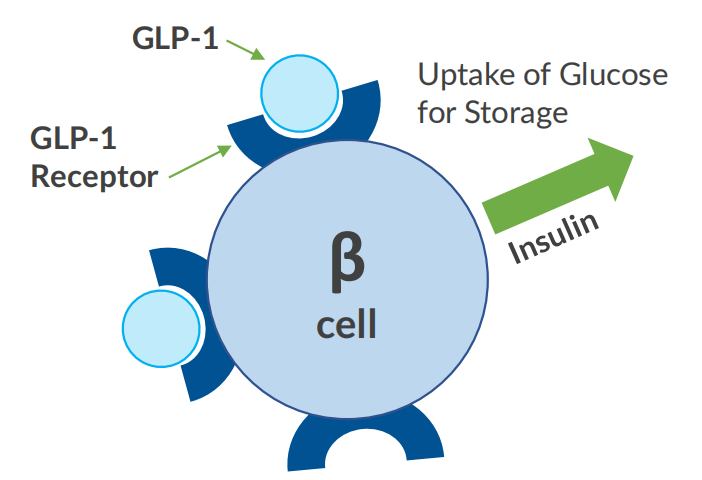
图3:β细胞上GLP-1与GLP-1受体的结合
GIP和GLP-1在糖尿病和肥胖中的其他作用
除了刺激β细胞分泌胰岛素外,GIP和GLP-1还刺激β细胞增殖和新生,并通过抗凋亡和抗炎作用促进β细胞存活。GIP和GLP-1受体存在于胰腺、脂肪组织、骨骼和大脑中。GIP抑制胃酸分泌,促进脂肪组织中的能量储存,并在高脂饮食(HFD)诱导的肥胖和胰岛素抵抗中发挥关键作用。GLP-1抑制胃排空,并参与抑制内脏脂肪组织中的炎症。它还显示出减少饥饿感和食物摄入量的作用。
GIP和GLP-1相关的糖尿病治疗药物
与GIP不同,GLP-1在血糖浓度高于空腹水平时具有直接的降血糖作用。大剂量GLP-1已显示出恢复β细胞葡萄糖敏感性的能力。然而,由于DPP-IV的蛋白水解作用,GLP-1和GIP在循环中的半衰期分别小于2分钟和5到7分钟。GLP-1受体(GLP1R)激动剂是2型糖尿病的潜在治疗药物,它们通过激活GLP-1受体来降低血糖,同时不易受蛋白水解的影响。DPP-IV抑制剂通过减缓循环中GLP-1和GIP的降解而发挥作用。GLP-1治疗药物已显示出减少糖尿病和肥胖相关并发症的效果,包括心肌梗死、中风和心血管死亡。尽管确切机制尚未完全了解,但结合GIP和GLP-1元素的嵌合肽在促进2型糖尿病患者体重减轻和降低血糖水平方面比GLP-1类似物单独使用更有效。
肠促胰素在其他治疗领域
由于GIP和GLP-1的功能远远超出了胰腺的范围,因此基于肠促胰素的治疗方法的潜力也超出了糖尿病和肥胖的范畴。GLP-1类似物已被用于治疗心脏病、肺病和高血压。GLP-1对神经元具有促存活作用,刺激信号传导,减少神经组织炎症,防止突触丢失和退化,并改善认知功能。神经元表达的GLP-1可能在阿尔茨海默病和帕金森病中发挥作用。GIP已显示出促进骨形成的作用,而GLP-1则抑制骨吸收。在其他组织和器官中发现肠促胰素受体,导致了对肠促胰素基治疗方法的广泛疾病和紊乱的研究。
持续的研究
尽管研究人员对GIP和GLP-1的活性有了更多的了解,但肠促胰素的作用机制及其在1型和2型糖尿病以及肥胖中的作用尚未完全明确。研究发现和临床研究已经导致了几种基于肠促胰素的治疗糖尿病的药物的批准。对GIP和GLP-1功能、它们在糖尿病和肥胖中的作用以及对其他系统的影响的进一步理解将继续应用于新的治疗方法中。
ALPCO,提供这些仅供研究使用的糖尿病和肥胖症等领域的检测试剂盒,欢迎垂询ALPCO中国区总代理,艾美捷科技。
参考文献:
1. Pearce JMS (2020). Ernest Henry Starling and the birth of English Physiology. Hektoen International.https://hekint.org/2020/06/29/ernest-henry-starling-and-the-birth-of-english-physiology/. Accessed April 20, 2021.
2. Rehfeld J (2018). The origin and understanding of the incretin concept. Frontiers in Endocrinology. 9:387. PMID: 30061863.
3. Kim W and Egan JM (2008). The role of incretins in glucose homeostasis and diabetes treatment. Pharmacol. Rev. 60(4):470-512. PMID: 19074620.
4. Holst JMMJ (2019). The incretin system in healthy humans: The role of GIP and GLP-1. Metabolism Clinical and Experimental. 96:46-55. PMID: 31029770.
5. Campbell JE and Drucker DJ (2013). Pharmacology, physiology, and mechanisms of incretin hormone action. Cell Metabolism. 17:819-837. PMID: 23684623.
6. El K, et al (2021). GIP mediates the incretin effect and glucose tolerance by dual actions on α and β cells. Science Advances. 7:eabf1948. PMID: 33712466.
7. German MS (1993). Glucose sensing in pancreatic islet beta cells: the key role of glucokinase and the glycolytic intermediates. Proc. Natl. Acad. Sci. USA. 90(5):1781-1785. PMID: 8446591.
8. Baggio LL and Drucker DJ (2007). Biology of incretins GLP-1 and GIP. Gastroenterology. 132(6):2131-2157. PMID: 17498508.
9. Vasu S, et al (2020). Role of endogenous GLP-1 and GIP in beta cell compensatory responses to insulin resistance and cellular stress. PLOS One. 9(6):e101005. PMID: 24967820.
10. Holst JJ and Rosenkilde MM (2020). GIP as a therapeutic target in diabetes and obesity: Insight from incretin co-agonists. J. Clin. Endocrinol. Metab. 105(8):e2710–e2716.
11. Izaguirre M, et al (2019). GLP-1 limits adipocyte inflammation and its low circulating pre-operative concentrations predict worse Type 2 diabetes remission after bariatric surgery in obese patients J. Clin. Med. 8:479. PMID: 30970605.
12. Nadkarni P, et al (2014). Regulation of glucose homeostasis by GLP-1. Prog Mol Biol Transl Sci. 121:23-65. PMID: 24373234.
13. Rowlands J, et al (2018). Pleiotropic Effects of GLP-1 and Analogs on Cell Signaling, Metabolism, and Function. Frontiers in Endocrinology. 9:672. PMID: 30532733.
14. Drucker DJ (2018). Mechanisms of action and therapeutic application of Glucagon-like Peptide-1. Cell Metabolism. 27:740-756. PMID: 29617641.
15. Seino Y, et al (2010). GIP and GLP-1, the two incretin hormones: Similarities and differences. Journal of Diabetes Investigation. 1:1/2:8-23. PMID: 24843404.
16. Kanemaru Y, et al (2020). Absence of GIP secretion alleviates age-related obesity and insulin resistance. Journal of Endocrinology. 245(1):13-20. PMID: 31977316.
17. Edholm T (2010). Differential incretin effects of GIP and GLP-1 on gastric emptying, appetite, and insulin-glucose homeostasis. Neurogastroenterol. Motil. 22(11): 1191-200. PMID: 20584260.
18. Fries, et al (2018). Efficacy and safety of LY3298176, a novel dual GIP and GLP-1 receptor antagonist, in patients with type 2 diabetes: a randomized, placebo-controlled and active comparator-controlled phase 2 trial. The Lancet. 392(10160):2180-2193. PMID: 30293770

微信扫码在线客服