【介绍】
3D培养已成为在体外研究复杂系统(如肿瘤微环境(TME))的标准。这些系统有助于深入了解体内发生的细胞与细胞相互作用和信息交流。使用3D基质模拟复杂的TME(2),甚至开始模拟转移(3),通过提供细胞外基质(ECM)的成分并增强这些体外模型的生物学相关性(1,2)。传统上,3D培养系统是在Matrigel 中建立的,它改变了癌症体外研究的面貌,允许适当的细胞分化并组织成3D球体。尽管Matrigel系统的开发及时且具有创新性,但多年来遇到了多种并发症(1,2)。其中包括批次间重现性困难,因为Matrigel 的ECM成分可能不同,实验温度控制困难,以及存在影响研究的生长因子或蛋白质。有了更具重现性的系统,就有可能扩展系统的复杂性并纳入多种细胞类型,揭示关于细胞 -细胞相互作用/信号的信息(4)。这种对类似TME系统的深入了解将使研究人员能够理解如何抑制甚至逆转侵袭性癌症的恶性表型(2)。因此,通过这个系统,对于开发一种可重现的、无动物源的3D系统来研究TME的需求,有了一个答案。
VitroGel 3D系统已用于多种细胞系的持续培养(2),包括最近对PANC - 1的研究。开发胰腺癌新疗法的z大挑战之一是在2D培养中对治疗的高反应率,但在临床上最终失败。最近的工作揭示了在PANC - 1模型中3D球体形成所代表的体内样TME,当比较2D和3D模型时,阐明了多种基质蛋白、细胞代谢和对药物治疗反应性的显著改变(5)。结合我们对TME复杂性的理解,3D模型是在侵袭性和挑战性模型(如PANC - 1)中进行全面体外药物评估的理想选择。在这里介绍的研究中,VitroGel系统的优势允许均匀分布和球体形成,而没有Matrigel或传统水凝胶系统广泛接受的警告,如支架结构不良、不需要的蛋白质/生长因子、预凝胶溶液的不良pH或温度、复杂的操作步骤和困难的下游分析(1)。VitroGel 3D为3D细胞培养及其他提供了更快、更简单和更通用的解决方案。VitroGel 3D是一种室温稳定、无动物源、可调谐的水凝胶系统,紧密模拟ECM,允许细胞像在体内一样生长。这个3D细胞培养系统的设置仅需20分钟,包括10 - 15分钟的等待时间,在此期间,水凝胶被激活并随着含钙或含钠的细胞培养基的加入开始聚合。VitroGel 3D系统的多功能性允许进行2D和3D细胞培养、安全的体内使用以及通过系统的透明和可渗透性质轻松进行体外成像。此外,通过离心和移液可以轻松从VitroGel 3D系统中收集细胞,无需在细胞上使用降解酶。
【材料和方法】
VitroGel 3D - RGD细胞培养
为了评估在培养PANC - 1细胞时使用的水凝胶的适当浓度,将VitroGel 3D - RGD水凝胶(TWG002,TheWell Bioscience)与0.5X PBS溶液以1:0、1:1或1:3的比例(v:v)制备。然后将稀释的水凝胶溶液与PANC - 1细胞悬液(在含有10%FBS + 1x pen - strep的DMEM培养基中接种密度为5 x 10^5细胞/ mL)以4:1(水凝胶:细胞)的比例混合。将250?L的水凝胶 - 细胞混合物添加到24孔板的每个孔中,并在室温下稳定20分钟。在固化步骤之后,将250?L完全细胞培养基添加到水凝胶的顶部。使用部分培养基更换方法以防止干扰水凝胶结构:在第2天,不是去除覆盖培养基,而是向水凝胶的顶部培养基中额外添加200?L完全细胞培养基,并将细胞培养额外24至48小时。在这个孵育期后,每隔一天应更换水凝胶顶部60 - 70%的培养基。
活/死测定
8室盖玻片载有125?L水凝胶和200?L覆盖培养基。去除覆盖培养基,并用PBS洗涤3次,然后按照制造商的方案使用LIVE/DEAD 细胞成像试剂盒(488/570)(ThermoFisher R37601)进行活/死评估。然后使用共聚焦显微镜拍摄图像。免疫荧光:这些切片按照上述在8室盖玻片中制备(125?L水凝胶和200?L覆盖培养基)。去除覆盖培养基,并用PBS洗涤3次,然后按照制造商的方案使用Image - iT 固定/透化试剂盒、ActinGreen?488 ReadyProbes 试剂和NucBlue 固定细胞ReadyProbes 试剂(ThermoFisher)进行固定和染色。然后使用Leica TCS SP8扫描共聚焦显微镜和z - stack功能捕获图像。使用LAS X软件和ImageJ进行图像的处理和分析。
有关使用VitroGel 3D或VitroGel 3D - RGD系统的更多具体信息,请参考VitroGel用户手册(https://www.thewellbio.com/wp - content/uploads/2018/05/VitroGel - 3D - Protocol - Guidelines.pdf)。
【结果和讨论】
PANC - 1细胞在0.5X PBS中以1:0、1:1和1:3的浓度递增稀释的水凝胶溶液中培养。在第1天(图1,第1天),3D细胞培养在比例之间没有显示出差异;简单地说,在每种条件下,细胞都能够在水凝胶内均匀分布(图1)。当细胞培养至第7天时,基于水凝胶的浓度观察到显著差异(图1,第7天)。在每种条件下,单个细胞形成集落并聚集,然而,水凝胶与PBS的1:1和1:3稀释比允许单个细胞更快地分裂和扩展,形成更大的3D集落,如图1所示,其中蓝色核比其他两种条件下更多。
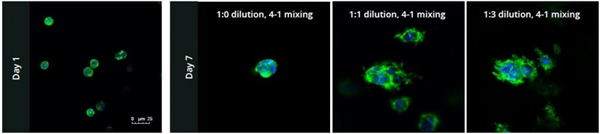
图1:第1天(左)和第7天(右)PANC - 1细胞在VitroGel 3D - RGD的三种不同稀释度下的代表性荧光显微照片,以及相应的抗体染色:NucBlue(核)和ActinGreen(肌动蛋白)。
3D培养系统的另一个关键组成部分来自于ECM的发展,它可以重现体内所见。在图2中查看ActinGreen / NucBlue染色的放大视图,揭示了在VitroGel 3D - RGD水凝胶中维持的PANC - 1细胞的细胞 - 细胞接触所产生的ECM的复杂性和分散性增加。这些结果表明,在1:3稀释的水凝胶中,PANC - 1 3D球体的生长速率和复杂性高于1:0和1:1水凝胶稀释度(图2)。
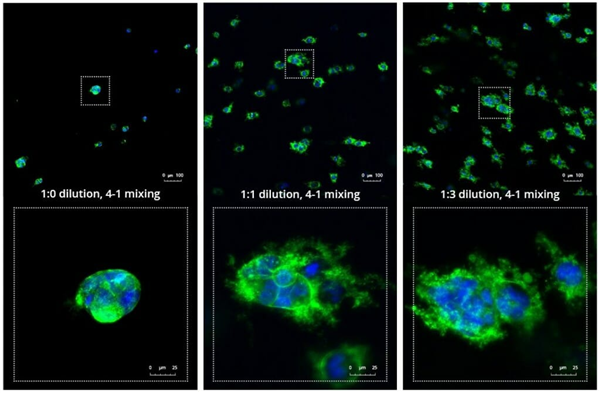
图2:第7天PANC - 1细胞在VitroGel 3D - RGD的三种不同稀释度下的代表性和放大(底部)荧光显微照片,以及相应的抗体染色:NucBlue(核)和ActinGreen(肌动蛋白)。
培养3D球体的一个担忧来自于球体中心可能会坏死的观念(6)。在这项研究中,用活/死测定评估球体。该评估显示在三种水凝胶稀释度中均没有显著的死亡(图3)。
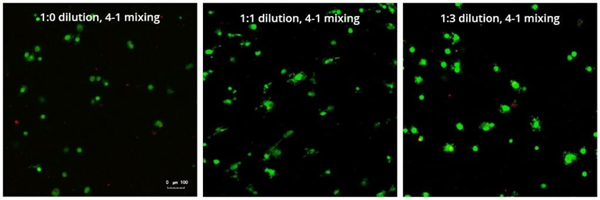
图3:在第7天,不同水凝胶强度浓度下的活/死测定,显示活细胞为绿色,死细胞为红色。
【结论】
VitroGel 3D - RGD系统是一种方便、时效高且成本低的系统,允许对在3D系统中生长的细胞的形态和行为进行准确和可重现的研究,而无需担心温度敏感性或额外的生物成分。评估VitroGel 3D - RGD系统与PANC - 1细胞的结果表明,对于这种细胞类型,用0.5X PBS稀释水凝胶在检查簇的大小和肌动蛋白定位时产生了更强大的PANC - 1球体。这些有希望的结果是验证一个系统的第一步,该系统现在可以在药物筛选研究中呈指数级扩展,并为临床提供信息,可能为在体外使用3D测定法使用患者细胞来了解特定疾病如何对治疗做出反应提供了有希望的一步。
【参考文献】
Powell, K, Adding depth to cell culture, Science Technology Feature (2017), 361(6402)
Rijal, G & Li, W, A versatile 3D tissue matrix scaffold system for tumor modeling and drug screening (2017), 3 (9)
Nawy, T, Metastasis in a dish, Nature Methods (2018), 7 (15)
Mahauad-Fernandez WD, Okeoma CM, B49, a BST-2-based peptide, inhibits adhesion and growth of breast cancer cells, Scientific Reports (2018), 8(4305)
Longati, P, Jia, X, Eimer, J, Wagman, A, Witt, M, Rehnmark, S, Verbeke, C, Toftgard, R, Lohr, M, Heuchel, R, 3D pancreatic carcinoma spheroids induce a matrix-rich chemoresistant phenotype offering a better model for drug testing, BMC Cancer (2013), 13 (95)
Chen, Y, Lou, X, Zhang, Z, Ingram, P, Yoon, E, High-Throughput cancer cell sphere formation for characterizing the efficacy of photodynamic therapy in 3D cell cultures, Scientific Reports (2015), 5 (12175)

微信扫码在线客服