| 概述 介绍 侧流免疫层析常见形式 关键试剂 经典侧流免疫层析分析的构建 将试剂应用到 LFIA 设备的组件上 试纸条组装 开发用于人IgG检测的侧流免疫 结果 参考 |
|
侧流免疫层析(lateral flow immunochromatography assay,LFIA;也简称为侧向层析)是一种基于抗原、抗体免疫反应的经典床旁检测技术(point of care testing,POCT)。侧流免疫层析试纸条,是一种在不使用实验室设备的情况下确认目标分析物是否存在的简易便携装置,作为是一种低成本、直接的方法,被广泛应用于检测人类和动物的感染或生物标志物,以及水、食物和动物饲料中的污染物和有害物质。
侧流免疫层析的3种常见形式:直接法(图1)、夹心法(图2)和竞争法(图3)。每个测试都是以线性条带形式运行的,由分离和检测感兴趣的分析物所需的材料制成,并提供一个对照反应以确认测试的正确进行。下面的例子概述了侧流免疫层析的基本原理,并简要地强调了条带的组成部分和它们的功能。
|
|
|
| 图1,直接法:用于检测人类抗体 | 图2,夹心法:用于检测生物液体中的抗原 | 图3,竞争法:用于样品中药物或危险化学品的存在 |
* 高清大图,欢迎垂询艾美捷客服索取
选择正确的抗体是开发成功的侧向流动免疫测定法的关键因素。
“如果没有认真测试筛选合适的抗体,那么再多的优化都无法克服这种固有的缺陷”(Brown,2008 年)
亲和力
亲和力特别重要,因为抗原的相对丰度可能很低。由于抗原、抗体偶联物和包被的抗体在测试条的分析区域中相互作用仅几秒钟,因此需要快速的 kon速率和慢的 koff速率。
特异性
抗体必须能特异性地识别目标抗原,而不能检测类似或同源的蛋白质和分子。由于在LFIA测试中使用了高浓度的抗体(通常比ELISA板孔中的抗体浓度高25-100倍),出色的特异性也是至关重要的。胶体金抗体偶联物通常以每次30-250ng的量被使用。如果假设样品在10-50ul内使标记的抗体再水化,那么抗体结合物的浓度将在0.6到20ug/ml之间。在较高的浓度下,抗体可能是其Kd的100倍,这可能会促使结合力弱、特异性低的抗体产生非特异性的相互作用,从而导致假阳性。
LFIA 的抗体可以在内部制造或从商业来源购买。
数量
首先要考虑的因素之一是启动和维持商业产品所需的数量。如果每条带 1ug 的捕获抗体并希望制作 100 万条,则所需的抗体量至少为 1g。因此,确保供应商能够以一致的质量生产大批量产品至关重要。如果要在内部制造抗体,则必须注意选择合适的抗原、免疫方法、筛选策略和放大工艺。
克隆性
单克隆抗体
单克隆抗体 (MAb) 的开发和生产是获得具有所需属性和保证质量稳定的抗体的有效方法。然而,在体外条件下的放大可能会很昂贵,并且在纯化运行之间可能会出现批次间的差异。筛选单克隆抗体以识别那些在膜结合、标记和与最终测定中使用的其他抗体一起表现良好的单克隆抗体也很重要。抗体在与膜结合时作为捕获剂工作良好,但在与报告分子结合时表现不佳的情况并不少见。最后,筛选还必须识别在实验条件下识别检测形式中表位的抗体,例如缓冲液成分或抗原的构象结构。
多克隆抗体
多克隆抗体 (PAb) 的生产很容易扩大规模,无论是使用兔子、山羊、鸡还是驴作为宿主动物。PAb 的另一个优点是它们也可用于实现更高的检测灵敏度。作为IgG的混合物,每种IgG同时和组合识别抗原上的不同表位,它们允许沉积更多的报告分子,从而增加信号。PAb 可能存在批次间差异,但由于它们是由宿主动物的免疫系统产生的,可能会随着时间而改变。
验证
无论来源或制造方法如何,都需要使用相应的工作流程来检验,以确保测试的一致性和可重复性。
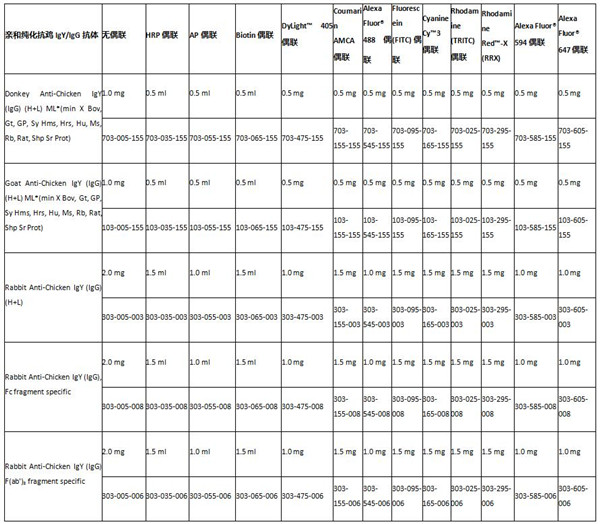
虽然开发或选择合适的捕获和检测抗体对检测的性能至关重要,但在LFIA中使用的控制试剂的选择也很重要。与报告分子偶联的IgG或二抗通常被用来设置必要的对照线/质控线,以确保测试的正确可信。例如,阳性对照线可以用抗鸡的二级抗体,该抗体与偶联的鸡IgY结合。鸡IgY经常被使用,因为与哺乳动物IgG相比,鸡IgG的同源性和序列特征较低,因此产生的非特异性相互作用较少。对照线抗体也应该与LFIA中使用的其他抗体有最小的交叉反应,因为如果测试中使用的IgG或样品中存在的IgG干扰了对照试剂的结合,那么对照线的强度就会有很大的变化。
点击浏览:亲和纯化IgG,更多产品欢迎垂询Jackson中国区金牌代理,艾美捷科技
常见抗鸡二抗预览:
血清学LFIA,使用抗体来捕获或检测由患者免疫反应产生的IgG。在血清学LFIAs中,检测线是涂有抗原的,而病人的样本中含有特定同型的抗原IgG,通过与病人血液中的IgG结合,而产生信号,该抗体与检测线上的抗原相结合(见图1)。检测抗体的特异性很关键,它不应该与检测中使用的其他物种的抗体或其他同种型的抗体结合。例如,在独立检测IgG和IgM同种型的检测中,抗IgG抗体不能与IgM发生交叉反应,而抗IgM抗体不能检测IgG。
常用于侧流免疫层析的报告分子包括胶体金、乳胶珠和荧光染料。每种选择都有明显的优势,选择取决于检测目标和检测读出方法。其他标签包括顺磁颗粒、酶、量子点、纤维素纳米珠、纳米金、二氧化硅纳米颗粒、生物发光和发光材料,以及上转换荧光剂(Goryacheva等,2013,Quesada-González & Merko?i,2015,和(Guo等,2021)。在此阅读更多关于报告分子与偶联物的信息。
胶体金(Colloidal Gold)
胶体金是一种广泛用于LFIA的偶联物,因为它能产生强烈的颜色,易于偶联,并且它的质量稳定。典型的尺寸在40-80nm之间,其中40nm是最常见的。
金颗粒与抗体的结合通常是通过静电和疏水的相互作用被动进行的。这两个实体在低离子强度的缓冲液中混合,然后用多元醇或蛋白质如白蛋白或酪蛋白进行封闭。胶体金也有活化的表面,如羧基,允许在必要时进行共价连接。
点击浏览:胶体金产品 ,更多产品欢迎垂询Jackson中国区金牌代理,艾美捷科技
乳胶微粒
乳胶颗粒用途广泛,自其最初开发以来一直被用于侧向流检测。颗粒可以装载彩色和/或荧光染料、顺磁颗粒和其他化学品。不同颜色的染料可以进行多种同时读出的检测。用于LFIA的标准尺寸范围为100-300um。缀合方法在吸附或共价连接之间变化,取决于表面化学。乳胶珠的敏感度可能低于胶体金,因为它们的大尺寸使它们不能密集地包装在测试或控制线上。
荧光染料
荧光染料作为标签得到了青睐;作为小分子(<1nm),它们比较大的纳米颗粒更容易从偶联垫中释放出来。染料有助于通过一个LFIA设备对多种分析物进行定量和检测(Wild,2016),尽管它们需要使用特殊的阅读设备来显示结果并充分利用染料的特性。适用于LFIAs的荧光团应该是经济的,具有长斯托克斯位移,良好的量子产率,并且是光稳定的。染料有多种形式,便于与蛋白质和小分子上的伯胺和巯基共价偶联。荧光素Fluorescein 和Cyanine染料是流行的选择。
一些染料可能不适合用于LFIA,因为在高浓度下会出现光漂白或淬灭。结合活性可能会因为发生在抗体副体或目标表位的关键点上的共价偶联而受到影响,或者因为疏水性染料引起的聚集。
| 点击浏览:荧光染料, | 点击浏览:链霉亲和素(Streptavidin) |
*更多产品欢迎垂询Jackson中国区金牌代理,艾美捷科技
任何LFIA的成功也取决于其材料成分,(图4),制造商通常使用不同的专有方法和试剂进行生产。出于这个原因,应该对来自不同来源的材料进行评估,以确保开发出准确和可靠的测试。测试优化是一个反复的过程,可能需要几个月才能完成。下文简要介绍了每个组成部分,并考虑了它们在生产有效的LFIA中的重要性。
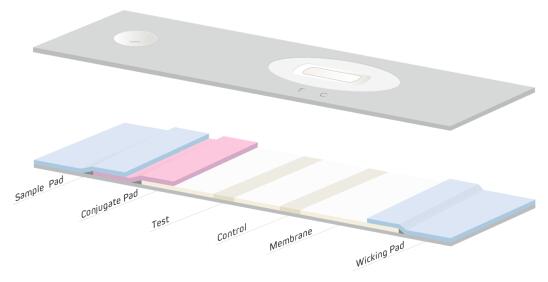
图4
LFIA的第一步是通过样品垫将样品引入设备(图4)。样品垫材料的选择取决于标本的性质和被检测的分析物。样品垫能分离过滤样品中的杂质,对样品进行前处理,平衡待测试样品的PH和调整盐离子强度,使样品在层析过程中保持一定的均一性和可控性。样品垫的材料主要选择玻纤、无纺布和滤纸。
样品中自由流动的物质从样品垫迁移到偶联垫。偶联垫是抗体和其他蛋白质或与报告分子(如胶体金、彩色乳胶颗粒或荧光染料)附着的载体。可以添加额外的成分,如糖类,以确保干燥的浸渍试剂在环境温度下的稳定性,并延长保质期。当样品移入偶联垫时,偶联物被重新水化并与样品成分相互作用。然后它们移到膜上,膜稍微重叠。偶联垫通常由玻璃纤维、聚酯纤维或人造纤维制成。
试剂-样品混合物通过膜迁移,免疫测定完成并可视化。 LFIA 中使用的膜会影响灵敏度、速度和整体背景(Huang 等人,2016 年和 Wild & Mansfield,2016 年)。 更快的流速可以降低背景,但会影响灵敏度,导致假阴性。 当由于分析物驻留时间增加而需要高灵敏度时,使用较慢的芯吸速率。 缓慢的芯吸速率可能会导致假阳性信号,因为不充分特异性的抗体会导致较高的背景。
硝酸纤维素膜(NC膜)因其高蛋白质结合能力和广泛的可用性而被普遍使用。 膜制造商添加专有的表面活性剂、润湿剂和其他化学品来控制蛋白质结合和芯吸速率,从而实现一致的分析性能。

应用在硝酸纤维素膜上的抗体通过亲水相互作用在接触时结合。抗体在应用点上结合,而不会随缓冲液扩散。涂抹抗体后,水在40°C的强制空气下挥发,抗体通过疏水作用固化在膜上。如果需要的话,膜的封闭通过浸泡在封闭缓冲液中,然后再进行干燥。有效的干燥对LFIA的性能至关重要,因为它确保了生物分子的稳定性和均匀的再湿润。包被的材料应在精心控制的温度和约20%湿度下储存。
位于侧流试纸条远端的吸水垫,将硝化纤维膜上的载液/缓冲液从测试线和对照线吸到试纸条的末端。样品和偶联物继续被吸入测试条,直到没有更多的液体可以被吸走,或者吸液垫变得饱和。高密度纤维素常被用于此目的。
为了确保LFIA的可预测和可重复性,抗体、抗原、缓冲盐和结合物应该以统一和可重复的方式应用到膜或垫上。根据包被材料,或开发或制造过程的阶段,可以使用各种方法。LFIA制造需要能够产生一致的流动特性的设备和能够实现高产量的应用方法。
浸没
通过将垫浸入含有这些成分的溶液中,然后吸干和干燥缓冲剂、封闭剂和偶联物等材料。
Tips: 将抗体和蛋白质应用于膜或偶联垫需要更高的精度,以获得生产批次之间的均匀性;因此,专门的点胶设备是必要的。
气动接触分液器
气动接触分液器通过泵送材料,使材料通过与膜或偶联垫接触的柔性点胶头,来分液。点胶头和膜的相对移动,沿着材料形成一条均匀的试剂线。接触式分液器通常很经济,而且可以在小空间内容纳。然而,它们会损坏膜,而且在大规模的生产操作中可能难以控制。因此,它们通常在研究和开发过程中使用,在这种情况下,需要低量的条状物来进行检测优化。

非接触式喷点器
非接触式喷点设备,如喷笔或喷墨液滴喷点器,利用高精度的泵来输送低至1nL大小的液滴,可以形成小至200um宽的线条/条纹。强制空气也可以被引入,以达到类似于艺术家的喷笔喷雾的效果。这两种非接触方法都可以分配试剂,其CV值或优于+/-1%,适合于大规模生产。
LFIA的材料成分被层压在一个涂有粘合剂的柔性塑料背板上,以提供硬度,从而使测试条能够被轻易地处理。在每个材料的接口处有足够的重叠,最小为2毫米,这是必要的,这样样品液体就可以从一个部分无缝地流向另一个部分。当材料被应用到背板上时,要使用均匀的压力以确保样品沿着测试条均匀地流动。这个 "卡片 "组装好后,条状物被切割成大约5mm的一致宽度。然后,测试条可以被放入精心设计和成型的塑料外壳中,以确保使用者在正确的区域加入样品,并实现适当的流动。塑料外壳中还包括一个带有适当标记的窗口,以方便结果的正确读取。
测试条不需要与样品或结合物垫一起组装。以这种方式构建的试纸条通常被称为 "半条"。它们通常在开发过程中用于筛选抗体、偶联物和其他试剂。在试管或96孔板中混合少量的样品和报告偶联物,例如50uL,然后将半条带的自由膜端放入溶液中。混合物在毛细作用下沿着条带向上迁移,最终到达吸水垫。该条带可以被移除并读取,或者转移到含有其他溶液的试管中,这些溶液被抽吸起来,直到吸水垫饱和。
在介绍了侧流免疫分析的形式和结构后,下面将介绍一个简单的检测人IgG和IgM的开发实例。
血清学检测能够对疾病进行监测,从最初的感染一直到免疫力的产生。血清学检验的是对病人体内抗体的特异性检测。侧流免疫分析法被广泛用于检测人类IgG。在这里,我们展示了Jackson ImmunoResearch公司的抗人类同种型特异性抗体在LFIA格式中的效用。
构建了一个基于半条形侧流免疫层析实验的双抗夹心法,专门检测人血清中的人IgG与IgM。需要设置对照线,以确保测试的正确进行。下图(图5)表示了检测的设置和指示阳性检测的交互作用。
| 捕获人IgG | 山羊抗人IgG, Fcγ fragment specific (min X Bov, Ms, Rb Sr Prot) (109-005-170) |
| 检测人IgG | 40nm胶体金偶联山羊抗人IgG, Fcγ fragment specific (min X Bov, Ms, Rb Sr Prt) (109-405-170), 与IgG的各亚型结合,具有特异性,与人类IgM的交叉反应性最小。 |
| 捕获人IgM | 山羊抗人IgM, Fc5u fragment specific (min X Bov Sr Prot) (109-005-129) |
| 检测人IgM | 40nm胶体金偶联山羊抗人IgM, Fc5u fragment specific (min X Bov Sr Prot) (109-405-129). 这个抗体同样极具特异性,且与上述捕获人IgG试剂(109-005-170)交叉反应最小。 |
| 捕获 | 驴抗鸡IgY (IgG) (H+L) (min X Bov, Gt, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat, Shp Sr Prot) (709-005-155) |
| 检测 | 40nm胶体金偶联ChromPure Chicken IgY (003-400-003) |
| 封闭 | 牛血清白蛋白,无IgG,无蛋白酶(001-000-161) |
抗体被涂在Whatman FF170HP硝酸纤维素膜上,以产生反映典型LFIA流动特征的条带。捕获抗体在PBS中稀释至0.3mg/ml,并以60ul/min的速度连续分配到以10mm/s速度移动的膜上。通过使用注射泵,通过与膜直接接触的PEEK管来控制分配速度。剥离后,膜在40°C强制空气下干燥,然后将膜浸入1%的BSA在PBS中的溶液中封闭1小时,接着清洗,然后在40°C强制空气下干燥过夜。
干燥后,将膜贴在自粘性底板上,并加入纤维素吸水垫(Ahlstrom 222级),与硝酸纤维素膜重叠约2mm。膜被切割成0.5cm的单独条带,在使用前被放置在含有干燥剂的干燥器中至少48小时。
捕获抗体在硝酸纤维素NC膜进行条带化,得到每线性cm含有 0.3ug 抗体的线:
IgG 测试线:山羊抗人 IgG,Fcγ 片段特异性(min X Bov,Ms,Rb Sr Prot)(109-005-170) ;
IgM 测试线:山羊抗人 IgM,Fc5u 片段特异性 (min X Bov Sr Prot) (109-005-129) ;
对照测试线:驴抗鸡 IgY (IgG) (H+L) (min X Bov , Gt, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat, Shp Sr Prot) (709-005-155)。
用 PBS 中的 1% 牛血清白蛋白(无 IgG,无蛋白酶)(001-000-162) 封闭膜,然后干燥并应用芯吸垫。
将侧向流动测试条置于 50 ul 混合物中,其中包含检测抗体:40 nm 金偶联物,0.8 OD520/ml ChromPure 鸡 IgY (IgG)-全分子 (003-400-003)、山羊抗人 IgM、Fc5u片段特异性 (min X Bov Sr Prot) (109-405-129) 和山羊抗人 IgG, Fcγ 片段特异性 (min X Bov, Hrs, Ms Sr Prot) (109-405-098)。
其他孔也加入了 50 ng 纯化的人IgG:ChromPure 人 IgG,全分子 (009-000-003) 和 ChromPure 人 IgM(myeloma),全分子 (009-000-012) 或使用PBS 1:200稀释的人血清。运行测试 15 分钟后,将试纸转移到含有 PBS 的孔中以去除多余的金结合物。
用于侧向流检测的抗人类多克隆抗体
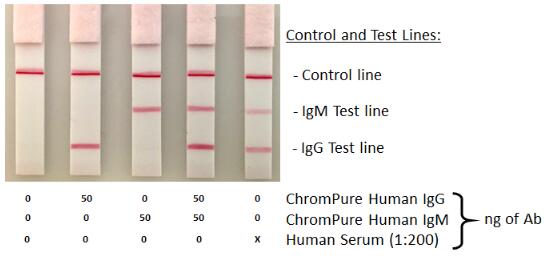
图5
所有的测试都是在96孔板中进行的,时间不到20分钟。试剂的浓度和其他参数需要优化。这些参数包括:捕获抗体、检测偶联物、测定缓冲液条件以及需要封闭膜。最终条件详见方法概要。
捕获抗体和检测抗体产生了强烈的阳性测试线,表明在人血清存在的情况下检测特定的IgG同种型。虽然这里没有显示,但在这种形式下也能检测到亚ng的人类IgG。
然而,使用纯人血清确实产生了 "HOOK效应",导致样品在血清中的浓度越高,信号就越少,因此在使用前必须将血清在PBS中稀释1: 200。通过使用大量的金结合物可以避免稀释,但这可能会导致结果解释上的困难,并且需要追随缓冲液清洗步骤来帮助分析。本实验中包括一个洗膜步骤以提高清晰度。
在生理条件下用BSA封闭和用Tween 20缓冲,改善了样品的流动性。纤维素吸水垫非常有效,如果长时间放置,可使整个样品被吸走。
这个简短的案例研究表明,Jackson抗体适用于检测人血清中的特定IgG同种型,证明它们适合用于POCT检测中侧流免疫层析产品的开发。
| 点击浏览:抗人二抗 | 点击浏览:了解更多血清学 |
*更多产品欢迎垂询Jackson中国区金牌代理,艾美捷科技
Bishop, J.D. et al., 2019. Sensitivity enhancement in lateral flow assays: a systems perspective. Lab on a Chip, 19(15), pp.2486–2499.
Brown, M.C., 2008. Antibodies: Key to a Robust Lateral Flow Immunoassay. Lateral Flow Immunoassay, pp.1–16.
Goryacheva, I.Y., Lenain, P. & Saeger, S.D., 2013. Nanosized labels for rapid immunotests. TrAC Trends in Analytical Chemistry, 46, pp.30–43.
Guo, J. et al., 2021. Nanomaterial Labels in Lateral Flow Immunoassays for Point-of-Care-Testing. Journal of Materials Science & Technology, 60, pp.90–104.
Huang, X. & El-Sayed, M.A., 2010. Gold nanoparticles: Optical properties and implementations in cancer diagnosis and photothermal therapy. Journal of Advanced Research, 1(1), pp.13–28.
Huang, X. et al., 2016. Membrane-based lateral flow immunochromatographic strip with nanoparticles as reporters for detection: A review. Biosensors and Bioelectronics, 75, pp.166–180.
Quesada-González, D. & Merko?i, A., 2015. Nanoparticle-based lateral flow biosensors. Biosensors and Bioelectronics, 73, pp.47–63.
Vashist, S.K., Luong, J. & Amerongen, A.V., 2018. Lateral Flow Immunoassays. In Handbook of immunoassay technologies: approaches, performances, and applications. London: Elsevier/Academic Press, pp. 172–173.
Wild, D., 2016. Lateral flow immunoassay systems. In The immunoassay handbook: theory and applications of ligand binding, ELISA and related techniques. Amsterdam ; Boston ; Heidelberg ; London ; New York ; Oxford ; Paris ; San Diego ; San Francisco ; Singapore ; Sydney ; Tokyo: Elsevier, pp. 89–107.
Wild, D. & Mansfield, M.A., 2016. Nitrocellulose Membranes for Lateral Flow Immunoassays:A technical Treatise. In The immunoassay handbook: theory and applications of ligand binding, ELISA and related techniques. Amsterdam ; Boston ; Heidelberg ; London ; New York ; Oxford ; Paris ; San Diego ; San Francisco ; Singapore ; Sydney ; Tokyo: Elsevier, pp. 95–113.
* 本文自Jackson官网专栏汉化,英文原文可联系艾美捷客服索取

微信扫码在线客服