【介绍】
由于体外检测在进行优化和临床前验证时具有高通量功能和成本效益,因此在药物发现应用中变得越来越受欢迎。三维(3D)培养检测尤其受欢迎,因为与传统的二维(2D)细胞培养相比,3D培养提供了更具生理相关性的环境(1 - 4)。比较研究表明,2D培养会失去组织特异性结构,导致机械和生化信号的改变,并中断细胞-细胞或细胞-基质的相互作用(5)。这些差异在药物开发中变得极为重要。虽然许多药物在2D培养中表现出成功,但这可能无法在体内转化,因为体内绝大多数细胞的3D环境可能使药物难以攻击所有细胞(7)。
TheWell Biosciences的VitroGel 系统是一种可调谐的水凝胶系统,随时可用。它可用于2D和3D系统,以及体外和体内应用。水凝胶可根据VitroGel的浓度和细胞密度进行调整,以适应任何细胞类型,并可与任何培养基混合以生成支架。VitroGel系统已被用于为各种应用创建许多不同细胞类型的3D结构。例如,最近一项分析新型抗癌肽功效的研究发现,乳腺癌细胞在培养中与其他细胞形成球体群(6)。添加他们的新型肽导致球体破坏,表明它可以抑制不依赖粘附的细胞生长,这一结论在二维环境中可能无法阐明。
在这项研究中,我们评估了HCT116细胞在VitroGel系统中用于2D涂层、3D培养和药物测试的活力和存活情况(8)。在这项研究中,使用了VitroGel 3D和VitroGel 3D - RGD(用于更好细胞粘附的RGD肽修饰水凝胶系统)。HCT116是一种人类结肠直肠癌细胞系,常用于结肠癌研究和治疗药物开发。这些研究确立了VitroGel系统作为一种可行的手段,用于使用HCT116细胞作为结直肠癌模型进行药物开发的研究。
【材料和方法】
细胞培养
HCT116细胞在含有10%FBS和1x pen - strep的McCoy's 5a培养基中在T - 25培养瓶中维持培养。当培养物达到约80%汇合时进行传代。对于3D细胞培养和药物测试,使用VitroGel 3D - RGD(TWG002,TheWell Bioscience),对于2D培养,根据用户手册(8),使用VitroGel 3D(TWG001,TheWell Bioscience)和VitroGel 3D - RGD,如下所述。
2D涂层培养方法
将水凝胶溶液与1X PBS以1:1的比例混合,然后以每孔250?L转移到24孔培养板中。为了稳定水凝胶,使其在室温下静置20分钟。将细胞悬液(约150K至200K细胞/ mL,250?L/孔)添加到水凝胶的顶部。在第2天,向顶部培养基中额外添加200?L完全细胞培养基。此后,根据TheWell Bioscience用户手册(8)更换顶部培养基,每隔一天更换顶部培养基的60 - 70%。
3D培养方法
将水凝胶溶液与0.5X PBS溶液以1:0、1:1和1:2的比例(v/v)稀释。将细胞悬液以2:1的比例混合(2mL稀释的水凝胶溶液与1mL细胞悬液,最终细胞浓度:150K至200K细胞/ mL)。将水凝胶/细胞混合物以每孔250?L添加到24孔板中。然后将水凝胶在室温下稳定20分钟。稳定后,在水凝胶顶部添加250uL完全细胞培养基。在第2天,向顶部培养基中额外添加200?L完全细胞培养基。此后,根据TheWell Bioscience用户手册(8)更换培养基,每隔一天更换顶部培养基的60 - 70%。
药物测试
将HCT116细胞以500K细胞/ mL的密度接种在VitroGel 3D - RGD(1:1 0.5X PBS稀释,2:1混合)的腔室盖玻片上,分别培养3天。在第4天,将抗癌药物(5 - 氟尿嘧啶,Sigma)以0?M、10?M、25?M、50?M的浓度添加到2D和3D培养细胞的顶部。用药物处理细胞3天。在第7天,去除顶部培养基,并根据制造商的说明进行活/死测定(Thermo Fisher R37601,LIVE/DEAD 细胞成像试剂盒)。使用Image J处理活/死染色的定量。
免疫荧光(IF)成像
对于IF成像,细胞在腔室盖玻片中生长,代替24孔板。每个腔室容纳125uL水凝胶/细胞混合物。根据制造商的方案,使用Image - iT 固定/透化试剂盒、ActinGreen?488 ReadyProbes 试剂和NucBlue 固定细胞ReadyProbes?试剂(ThermoFisher)对细胞进行固定和染色。使用具有z - stack功能的Leica TCS SP8扫描共聚焦显微镜拍摄图像,并通过LAS X软件和ImageJ进行处理。
【统计分析】
使用T检验进行统计,将药物浓度与0?M作为对照进行比较。P值小于0.05被认为是显著的(*),P值小于0.005非常具有统计学意义(**),P值小于0.001极其具有统计学意义(***)。
【结果】
HCT116细胞可以在2D涂层和3D VitroGel系统上生长
我们使用两种版本的VitroGel系统评估HCT116细胞(图1):标准的VitroGel - 3D系统,适用于悬浮细胞,以及RGD修饰版本,其中包含RGD肽修饰,RGD肽存在于所有主要的细胞外基质蛋白中,可以促进细胞对生物材料如凝胶的粘附(9)。在接种细胞后24小时和7天后再次对细胞进行评估。当使用2D涂层方法时,即在接种细胞之前让VitroGel水凝胶凝固,细胞根据使用的VitroGel系统版本采用不同的形态。在VitroGel 3D中,细胞在24小时后获得球形形状,并继续增大至7天。与标准的VitroGel 3D一样,VitroGel 3D - RGD上的细胞在24小时后也开始形成球形细胞簇。然而,与标准水凝胶不同的是,细胞在7天后扩散,呈现出类似于在标准处理培养塑料上的2D培养的形态。当在VitroGel 3D - RGD系统中使用3D细胞培养方法时,即在水凝胶凝固之前将细胞接种到水凝胶中,发现HCT116细胞在水凝胶内均匀分布。这个过程似乎开始得更慢;24小时后,细胞簇非常小,每个簇只有2 - 3个细胞。到第7天,簇生长成更小、更均匀大小的球体。
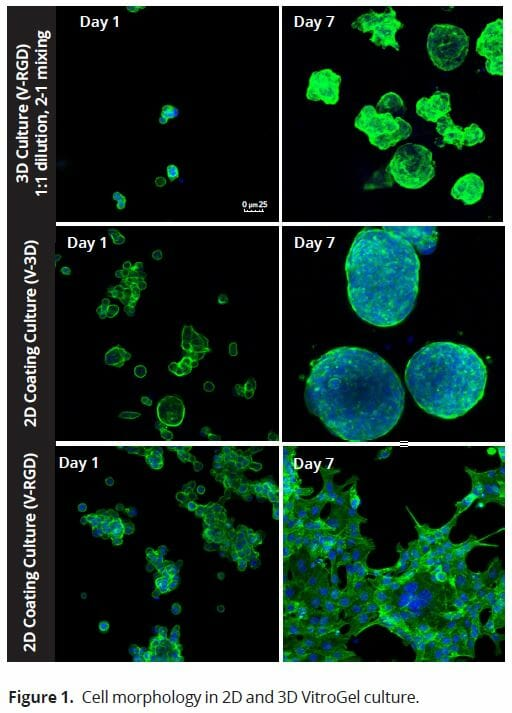
图1 2D和3D VitroGel培养的细胞形态
水凝胶的强度会影响其机械性能,从而影响细胞在水凝胶中的活力和反应。我们分析了HCT116细胞在三种不同水凝胶强度(浓度)下的生长潜力(图2)和活力(图3):1:0稀释(主要是水凝胶)、1:1稀释(水凝胶/ PBS)和1:2稀释。7天后,1:1水凝胶稀释允许形成大的集落,而其他稀释仅允许形成具有异常形态的小细胞簇/集落。通过活/死测定分析细胞活力表明,尽管集落大小减小,但在任何水凝胶稀释度下都没有显著的细胞死亡。尽管在1:0和1:2支架稀释中的细胞没有显示出许多死亡标记,但它们的形态表明它们可能正在死亡,如果尚未死亡的话。在1:1稀释中,细胞更多,尽管它们具有通常与细胞健康状况不佳相关的更平坦的形态,但认为支架中允许增加的细胞 - 基质相互作用阻止了在2D培养中使用的超低粘附板中看到的球体形态。这种形态可能表明良好的细胞 - 基质相互作用,这可能有助于模拟体内情况,并且还表明z佳的支架稀释度是1:1支架:PBS。
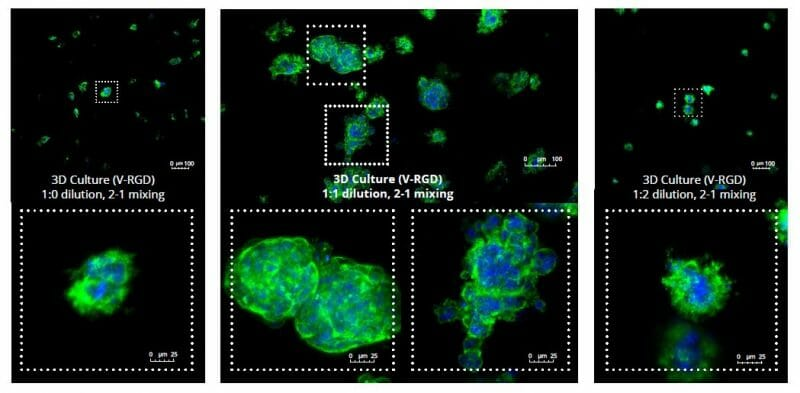
图2:HCT116细胞在不同水凝胶浓度下的3D细胞培养(底部显示放大的细胞)。

图3:HCT116细胞在不同水凝胶强度下的细胞活力。
VitroGel培养的HTC116细胞对5 - 氟尿嘧啶没有显著反应
5 - 氟尿嘧啶(5 - FU)是一种用于治疗包括结肠癌在内的多种癌症的常见抗癌药物。虽然它在结肠癌治疗中取得了一些成功,但最近的一些研究指出,许多患者对5 - FU产生了耐药性(10),其他研究发现5 - FU仅对具有错配修复基因突变的一小部分结肠癌起作用(11)。使用传统的2D细胞培养系统与3D培养系统对比测试5 - FU对HCT116细胞的作用表明,5 - FU的效果不显著(图4)。我们发现,在2D培养中,随着药物浓度从10?M增加到50?M,药物效率增加。然而,在3D细胞培养系统中,在任何阶段都没有显著的药物效果。只有在50?M的情况下,才有任何明显的效果,细胞集落的大小明显减小。使用活/死测定对细胞死亡的定量表明,在2D培养中死亡细胞的水平增加,表明5 - FU在杀死癌细胞方面的有效性。然而,在3D培养中,在任何阶段都没有显著水平的死亡细胞;直到50?M时几乎不存在。使用ImageJ对活细胞的定量表明,随着药物浓度的增加,活细胞数量稳步下降。然而,在3D培养中,这种下降并不存在。

图4. 用不同浓度的5 - FU处理后HCT116细胞的活力。P值小于0.05被认为是显著的(*),P值小于0.005非常具有统计学意义(**),P值小于0.001极其具有统计学意义(***)
【讨论】
基于这些结果,我们得出结论,VitroGel - 3D - RGD为传统的2D培养提供了一种可行的替代方案,用于药物研究。虽然标准VitroGel系统上的2D涂层培养也采用球形形态,但集落主要是通过细胞簇的聚集而形成的,而不是从单个细胞分裂而来。通过2D培养形成的球体也比从3D培养衍生的球体大得多,这可能使得营养物质和药物难以渗透到外层细胞之外。
在3D细胞培养中,我们研究了细胞形态、生长和存活对不同水凝胶强度(水凝胶稀释度)的响应。我们发现HCT116细胞生长存在最佳的凝胶强度:0.5X PBS与水凝胶等量。活/死测定的结果表明,细胞死亡没有增加,这表明在较低和较高水凝胶稀释度下细胞总数的减少是由于细胞与水凝胶的机械相互作用。先前的研究发现,活细胞的数量取决于基质的硬度,而死细胞的数量与之无关,这表明水凝胶的硬度可以影响增殖(12, 13)。事实上,对肝细胞癌细胞进行的研究表明,基质的机械性能不仅可以促进增殖,还可以调节化疗反应(14)。
与图2相关的上文中,我们观察到不同3D支架刚度的簇的不同部分甚至簇之间的肌动蛋白水平存在差异。一些簇比其他簇具有更多的肌动蛋白,并且不同刚度的支架中肌动蛋白的定位也不同。虽然我们仅使用肌动蛋白来观察簇的形态(即扁平与球形),但应该注意的是,有研究表明癌细胞在不同阶段的肌动蛋白水平会波动(15)。在研究中,肌动蛋白作为形态标记物是有用的,因为它是一种稳态基因,但它的实际功能与从收缩到细胞分裂和运动的多个细胞过程有关。一项研究发现,位于癌细胞前缘的肌动蛋白丝本质上是可运动的,并且周转率更高(16)。另一项研究发现,肌动蛋白在癌前和恶性乳腺肿瘤细胞中都起着主要作用,首先通过控制细胞硬度促进增殖,然后通过细胞柔软性允许侵袭(17)。不同支架刚度之间肌动蛋白定位和表达水平的变化以及表明癌细胞中肌动蛋白表达变化的研究表明,3D支架可以影响细胞的运动性。
因为细胞对基质刚度的反应独特,所以可能在实验之前必须对每个细胞系进行优化。然而,该系统在培养基兼容性方面提供的广泛灵活性以及其在体外和体内使用的潜力使VitroGel成为药物测试的绝佳选择,特别是对于肿瘤应用。
【参考文献】
Fang Y, Eglen R. Three-Dimensional Cell Cultures in Drug Discovery and Development. SLAS DISCOVERY: Advancing Life Sciences R&D. 2017;22(5):456-472.
Langhans S. Three-Dimensional in Vitro Cell Culture Models in Drug Discovery and Drug Repositioning. Front Pharmacol. 2018;22(5):456–472.
Edmondson R, Broglie J, Adcock A, Yang L. Three-Dimensional Cell Culture Systems and Their Applications in Drug Discovery and Cell-Based Biosensors. Assay Drug Dev Technol. 2014;12(4):207-218.
Kloxin A, Kloxin C, Bowman C, Anseth K. Mechanical Properties of Cellularly Responsive Hydrogels and Their Experimental Determination. Advanced Materials. 2010;22(31):3484-3494.
Zanoni M, Piccinini F, Arienti C et al. 3D tumor spheroid models for in vitro therapeutic screening: a systematic approach to enhance the biological relevance of data obtained. Sci Rep. 2016;6(1).
Mahauad-Fernandez W, Okeoma C. B49, a BST-2-based peptide, inhibits adhesion and growth of breast cancer cells. Sci Rep. 2018;8(1).
Powell K. Adding depth to cell culture. Science | AAAS. http://www.sciencemag.org/features/2017/04/adding-depth-cell-culture. Published 2017. Accessed August 13, 2018.
VitroGel. Thewellbio.com. https://www.thewellbio.com/wp-content/uploads/2018/05/VitroGel-3D-Protocol-Guidelines.pdf. Published 2018. Accessed August 13, 2018.
Bellis S. Advantages of RGD peptides for directing cell association with biomaterials. Biomaterials. 2011;32(18):4205-4210.
Bracht K, Nicholls A, Liu Y, Bodmer W. 5-Fluorouracil response in a large panel of colorectal cancer cell lines is associated with mismatch repair deficiency. Br J Cancer. 2010;103(3):340-346.
He J, Pei L, Jiang H, Yang W, Chen J, Liang H. Chemoresistance of colorectal cancer to 5-fluorouracil is associated with silencing of the BNIP3 gene through aberrant methylation. J Cancer. 2017;8(7):1187-1196.
Cavo M, Fato M, Pe?uela L, Beltrame F, Raiteri R, Scaglione S. Microenvironment complexity and matrix stiffness regulate breast cancer cell activity in a 3D in vitro model. Sci Rep. 2016;6(1).
Cook J, Fox D, Kuroki K, Jayo M, De Deyne P. In vitro and in vivo comparison of five biomaterials used for orthopedic soft tissue augmentation. Am J Vet Res. 2008;69(1):148-156.
Schrader J, Gordon-Walker T, Aucott R et al. Matrix stiffness modulates proliferation, chemotherapeutic response, and dormancy in hepatocellular carcinoma cells. Hepatology. 2011;53(4):1192-1205.
Yamaguchi, Hideki, and John Condeelis. “Regulation Of The Actin Cytoskeleton In Cancer Cell Migration And Invasion”. Biochimica Et Biophysica Acta (BBA) – Molecular Cell Research, vol 1773, no. 5, 2007, pp. 642-652.
Tavares, Sandra et al. “Actin Stress Fiber Organization Promotes Cell Stiffening And Proliferation Of Pre-Invasive Breast Cancer Cells”. Nature Communications, vol 8, 2017, p. 15237.
Lorente, Gisela et al. “Actin Filaments At The Leading Edge Of Cancer Cells Are Characterized By A High Mobile Fraction And Turnover Regulation By Profilin I”. Plos ONE, vol 9, no. 1, 2014, p. e85817.

微信扫码在线客服