聚(ADP-核糖)聚合酶(PARP)的抑制剂已经改变了癌症治疗的游戏规则,证明了靶向DNA损伤反应网络内互补途径的合成致死药物的潜在功效。然而,在完整细胞中评估聚ADP核糖基化是困难的,减缓了候选药物的开发。BPS Bioscience的LysA?通用PAR化测定试剂盒可定量并比较细胞提取物中存在的PAR化蛋白的量,从而确定培养细胞中化合物的功效,并弥合生化测定和动物试验之间的差距。在这里,我们讨论了该测定的原理,并提供了如何在完整细胞中评价PARP或PARG抑制剂的实验示例。
ADP-核糖单元对蛋白质的添加是参与细胞过程如DNA修复、染色质重塑和基因表达控制的重要翻译后修饰。它主要发生在与DNA损伤反应(DDR)相关的蛋白质中。这种添加有两种形式:单ADP核糖基化(添加单个ADP核糖单元,也称为MAR化)和聚ADP核糖基化(以线性或分支形式添加多个单元),也称为PAR化。
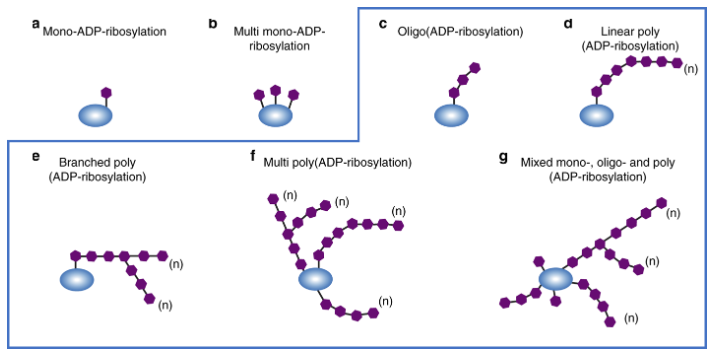
图1:各种形式的单ADP核糖基化和多ADP核糖基化的图示。在下述测定中使用的抗PAR抗体识别各种形式的聚ADP核糖基化,如蓝色框所示。
PAR化由称为聚(ADP-核糖)聚合酶(PARP)的17种酶的家族协调,其中PARP 1至PARP 5催化PAR化,而其他PARP执行MAR化(1)。 PARP 1、PARP 2和PARP 3具有严格的DNA依赖性。 PARP 1是主要的参与者,因为它负责高达80%的总细胞PARylation(1)。 PARP 1和PARP 2主要参与DNA修复,协调DDR网络。 PARP 2还控制表观遗传学、增殖、炎症和发育(5,6)。 相反,PARP 1改变转录并在DNA损伤无法修复时诱导细胞凋亡。 PAR化是可逆的,并且可以被PAR清除剂(例如聚(ADP-核糖)糖水解酶(PARG))解除(2,3)。
PARP1和PARP2感知单链DNA断裂,锁定在受损区域,然后将PAR链添加到其自身的骨架、组蛋白和其他修复蛋白中,以招募和激活这些蛋白质。然后,由于带负电荷的PAR链的变构阻碍,PAR化的PARP1或PARP2从DNA分离,允许其他蛋白质进入DNA并启动修复过程。PARG的工作是去除PAR链,将修复蛋白回收到其非活性形式,这是各种DNA修复过程中的关键步骤(4)。
PARP 1/2抑制剂已成为成功的癌症治疗药物,当肿瘤细胞中同源重组修复(HRR)有缺陷时,可导致合成性致死(7)。事实上,目前美国有四种FDA批准的药物在临床使用,还有更多的药物正在研发中。
另一方面,PARG活性失调与各种疾病有关,包括癌症(8)。靶向PARG治疗作为一种使癌细胞对DNA损伤诱导剂敏感的策略正在获得牵引力(9)。阻断PARG活性导致PAR在蛋白质上积聚,并干扰DNA修复机制,最终导致细胞死亡。因此,PARG抑制剂是一种有前途的治疗途径,特别是当与DNA损伤诱导的放射或化学疗法组合时。除了PARG,其他PAR清除剂也有助于PAR周转和DNA修复,如MacroD1和MacroD2(含大结构域的蛋白质),TARG1(也称为ARH3)和NUDT 16。
基于细胞的分析是药物开发过程的重要组成部分,因为它们使研究人员能够评估候选药物在活细胞中的生物活性,并更好地了解其作用机制。细胞测定对于评价化合物的膜渗透性问题和复杂系统内的干扰是必要的,并且与生物化学测定相比,总体上提供了化合物和活细胞之间复杂相互作用的更准确的表示。
因此,将药物候选物如PARG或PARP抑制剂添加到感兴趣的细胞中并测量所得的PAR化水平可以提供关于化合物在完整细胞中的有效性的宝贵信息。LysA?通用PAR化测定试剂盒评估细胞提取物中的PAR化,并允许测定化合物IC50,比较各种化合物的IC50,化合物在具有特定DDR缺陷的细胞中的作用等。
示例应用
测量化疗药物诱导的细胞应激后的总PAR水平(例如,指示PARP是否被激活以及激活到何种程度)。
筛选或确定IC50 PARP家族的抑制剂。
筛选或确定IC50 PARG家族的抑制剂(PAR擦除剂)。
为PAR稳态研究提供了一种新的细胞模型。
评价联合治疗可能产生的协同效应。
使用规定的PAR标准品定量生物样品中的PAR水平。
LysA?通用PAR化测定试剂盒是一种基于夹心ELISA的测定,旨在分析细胞提取物中存在的总PAR化水平。该试剂盒包括用于绝对定量的PAR标准品。该测定检测例如由诱导DNA损伤反应或暴露于PARP抑制剂或PARG抑制剂引起的蛋白质PAR化水平的差异。
原理:用对PAR化链特异性的抗PAR抗体包被96孔板。将来自细胞的裂解物加入包被的威尔斯孔中,并通过抗体捕获细胞裂解物中存在的PAR化蛋白。随后与抗PAR检测抗体孵育,然后与HRP偶联的二级抗体孵育。添加化学发光HRP底物提供了与细胞PARylation水平直接相关的发光信号。
该测定依赖于特异性抗PAR抗体,并且不检测单ADP核糖基化(MARylation)。
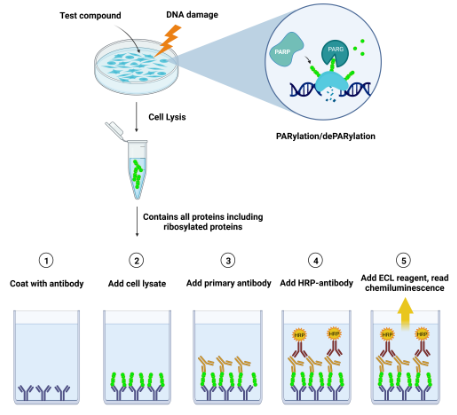
图2:测定原理说明
请记住,PAR水平反映了PAR写入器和PAR擦除器之间的稳态,预计添加特定抑制剂和/或使用DNA损伤剂将影响这种平衡。例如,添加PARG抑制剂通过阻断PAR去除而将系统推向增加的PAR化,而添加PARP抑制剂降低蛋白质PAR化。
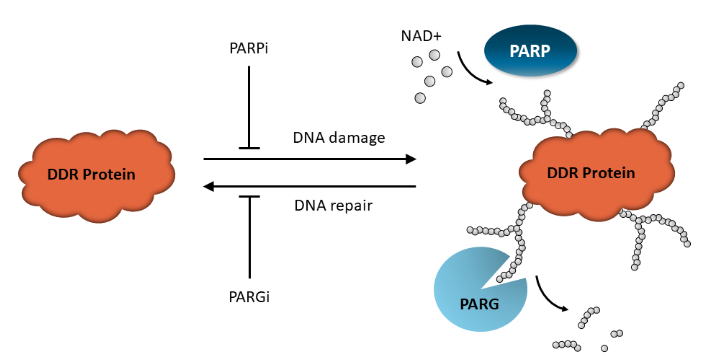
图3:PAR化稳态。DNA损伤激活PARP蛋白,导致形成PAR化DNA修复蛋白,包括PARP本身。一旦DNA修复启动,PAR擦除器如PARG从蛋白质中去除ADP-核糖单元,回收它们以再次响应DNA损伤。任一反应都可以被特异性抑制剂阻断,导致PAR化蛋白质的积累或非PAR化形式的突出,这取决于上下文。
| 产品名称 | 货号 | 规格 |
| RIPA裂解缓冲液 Modified RIPA Lysis Buffer (Moderate Strong) | 82126 | 20 ml |
| ADP-核糖基化循环抑制剂混合物 ADP-Ribosylation Cycle Inhibitor Mix | 82130 | 5 x 20 ?l |
| LysA?通用PAR化测定试剂盒 LysA? Universal PARylation Assay Kit | 82123 | 96 reactions |
| PARP抑制剂 Set of PARP Inhibitors | 78318 | 8 x 50 ?l |
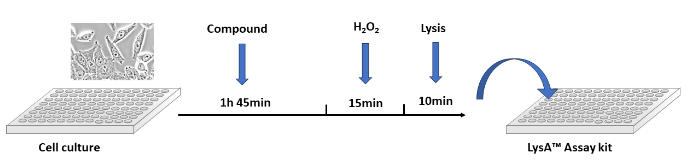
图4:在诱导DNA损伤之前,用目标化合物处理培养物中的细胞。裂解细胞并使用LysA?通用PAR化测定试剂盒进行分析。
1)PARG抑制剂PDD00017273在各种细胞系中的滴定
将HEK 293、MCF 7、MDA-MB-231和HeLa细胞以0.5 × 10 - 6的细胞密度接种在96孔细胞培养板中。5 细胞/孔,并在其相应的生长培养基中培养,直到它们达到约70%汇合,对于HeLa和HEK 293细胞约24小时,对于MCF 7和MDA-MB-231细胞约48小时。
在不改变生长培养基的情况下,在加入过氧化氢(H)之前,将细胞在37 ℃下在没有或有增加浓度的PARG抑制剂PDD 00017273(MedChem Express #HY-108360)的情况下处理1小时45分钟。2O2,500 μM终浓度)再孵育15分钟以诱导DNA损伤。请注意,PDD00017273贮备液最初在DMSO中制备,DMSO浓度(1%)在所有条件下(包括无抑制剂对照)保持恒定。
处理后,轻轻地从板上除去培养基,用冰冷的PBS(磷酸盐缓冲盐水)洗涤细胞一次,置于冰上,用50 μl/孔的改良RIPA裂解缓冲液(BPS Bioscience #82126)补充蛋白酶抑制剂混合物和ADP-核糖基化循环抑制剂混合物(BPS Bioscience #82130).
在冰上10分钟后,将裂解物上下吸移数次并收集。
立即使用LysA?通用PAR化测定试剂盒分析PAR化水平。在实验前一天,将前一步骤中收集的每种裂解物的全部体积(50 μl/孔)加载到涂覆的白色96孔模块Maxisorp?板中的相应孔中。
在遵循LysA?通用PAR化测定试剂盒方案(BPS Bioscience#82123)之后,使用Bio-Tek酶标仪测量发光。
结果表示为总PAR化的百分比(其中最大PAR化水平设定为100%)。
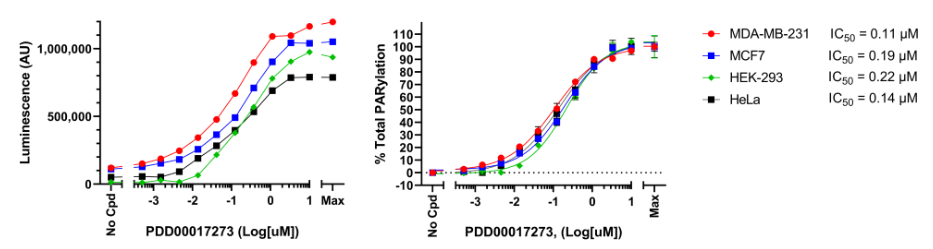
图5:PARG抑制剂PDD00017273对不同细胞系中H2O2诱导的蛋白质PAR化的影响.
如上所述,用递增浓度的PARG抑制剂和H2O2处理细胞使用LysA?通用PAR化测定试剂盒分析细胞裂解物。结果表示为原始发光信号(左)或归一化为总PAR化的百分比,其中每个细胞系的最大PAR化设定为100%(右)。对于每种细胞系,使用GraphPad Prism软件计算IC50并绘图。数据表示来自单个实验的生物学重复。
2)HEK293细胞中几种PARP抑制剂的滴定
将HEK 293细胞以0.5 × 10 - 6的密度接种在96孔细胞培养板中5 细胞/孔,并在它们的正常生长培养基中培养,直到它们达到约70%的汇合,约24小时。
在不改变生长培养基的情况下,将细胞用10 μM PARG抑制剂PDD 00017273(MedChem Express #HY-108360)与浓度增加的PARP抑制剂奥拉帕尼、他拉唑帕尼和AZD 5305(一组PARP抑制剂, BPS Bioscience #78318)在37°C下搅拌1小时45分钟。过氧化氢(H2O2,500 μM终浓度)再添加15分钟以诱导DNA损伤。请注意,抑制剂储备液最初在DMSO中制备,在所有条件下(包括不含PARP抑制剂的对照品),DMSO和PARGi的浓度保持恒定(分别为1%和10 ?M)。
轻轻地从板上除去培养基,用冰冷的PBS洗涤细胞一次,置于冰上,用50 μl/孔的改良RIPA裂解缓冲液(BPS Bioscience #82126)补充蛋白酶抑制剂混合物和ADP-核糖基化循环抑制剂混合物(BPS Bioscience #82130).
在冰上10分钟后,将裂解物上下吸移数次并收集。
立即使用LysA?通用PAR化测定试剂盒分析PAR化水平。将在前一步骤中收集的每种裂解物的全部体积(50 μl/孔)加载到实验前一天包被的白色96孔模块Maxisorp?板中的相应孔中。
在遵循LysA?通用PAR化测定试剂盒方案(BPS Bioscience#82123)之后,使用Bio-Tek酶标仪测量发光。
结果表示为总PAR化的百分比(其中在不存在抑制剂的情况下测量的PAR化水平设定为100%)。
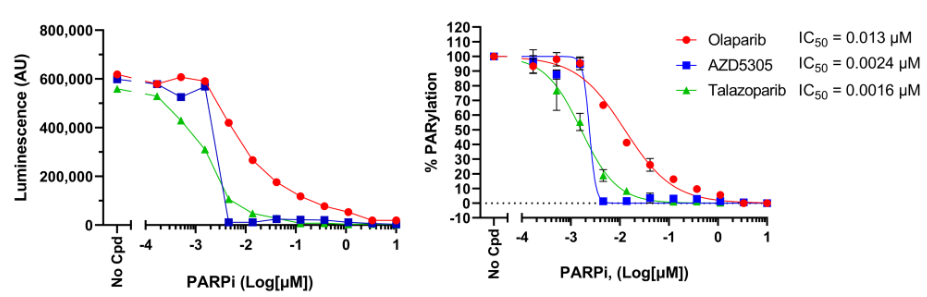
图6:PARP抑制剂对HEK 293细胞中H2O2
如上所述,在PARG抑制剂存在的情况下,用浓度增加的PARP抑制剂和H2O2结果表示为原始发光信号(左),并标准化为总PARylation的百分比,其中最大PARylation设置为100%(右)。对于每种条件,使用GraphPad Prism软件计算并绘制IC50。数据表示来自单个实验的生物学重复。
数据显示测量细胞PAR化水平以评估PARP或PARG抑制剂的功效的有用性。BPS Bioscience的LysA?通用PAR化测定试剂盒提供了一种方便、简单的测定方法,用于比较各种化合物在完整细胞中的作用。
引用:
(1) Ummarino S, et al. 2021 Genes 12(3): 446.
(2) O'Sullivan J, et al. 2019 Nat Communications 10(1): 1182.
(3) Harrision D, et al. 2020 Front Mol Biosci. 7: 191.
(4) Murai J, et al. 2012. Cancer Res. 72(21): 5588-99.
(5) Ali SO, et al. 2016 Am. J. Cancer Res. 6(9): 1842-1863.
(6) Rose M, et al. 2020 Front. Cell Dev. Biol. 8: 564601.
(7) Rudolph J, et al. 2022 PNAS USA, 119(11): e2121979119.
(8) Marques M, et al. 2019, Oncogene. 38(12): 2177-2191.
(9) James DI, et al. 2016, ACS Chem Biol. 11(11): 3179-3190.

微信扫码在线客服